
|
FDA 计划 2022 年在中国和印度恢复突击检查
2021.12.15
美国 FDA 监管事务办公室医药产品和烟草助理局长 Elizabeth Miller 2021 年 12 月 9 日在食品和药品法律研究所(FDLI)执法、诉讼和合规会议上表示,FDA 将恢复对印度药品和设施进行突击检查和临时检查的计划,并将该计划扩展到中国。
Miller 表示,“尽管面临挑战和旅行限...
|
|
FDA 表示 2021 财年检查数量远超预期
2021.11.24
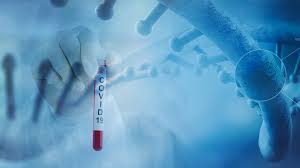
美国 FDA 于 2021 年 11 月 22 日更新了《FDA 检查监督弹性路线图》,表示其在 2021 财年下半年进行的国内监督检查数量是最初在春天发布的路线图中预测数量的两倍多。
在最初路线图中,FDA 估计在 2020 财年和 2021 财年计划完成的 15,000 多项国内监督检查会因大流...
|
|
美国政府审查报告证实新冠疫苗生产场地在获得授权之前...
2021.11.03
一直关注识林的读者可能还记得,去年 12 月份我们就曾讨论过 FDA 授权新冠疫苗之前并没有做批准前检查。现在美国政府的官方报告数据出来了,没做批准前检查是确定的,而其中的一些原液和重要辅料工厂甚至从未接受过 FDA 的检查。
美国政府问责办公室(GAO)在一份最新的报告中表...
|

|
欧盟更新检查和信息交换程序汇编,梳理检查程序和配套...
2021.10.28
欧盟于 2021 年 10 月 26 日公布了其《欧盟检查和信息交换程序汇编》更新版本,对汇编中涉及的文件进行了大幅修订和更新。
汇编以前被称为《行政协作和检查协调的共同体程序汇编》,是促进欧盟成员国 GMP 和 GDP 检查员之间合作的工具和实现协调的手段。其中程序为构成国家 G...
|

|
FDA 警告三家美国企业火灾影响调查不足,无视记录索...
2021.10.26
美国 FDA 于 10 月 19 日对美国非处方药(OTC)制药商、成品药制造商以及原料药(API)制造商分别发出了警告信,主要缺陷涉及对合同制造商(CMO)的监督不力、未能解决火灾如何影响 API 成分的质量以及无视 FDA 对企业电子记录的索要请求。
这三家企业分别是位于密苏里州的 API ...
|
|
FDA 2021 财年药品检查观察项和趋势
2021.10.21
美国 FDA 于 2021 年 10 月 18 日最新发布了 2021 财年检查观察项汇总数据,本文重点查看药品制剂方面的 483 相关缺陷数据。
由于新冠疫情继续在世界绝大多数国家和地区肆虐,2021 财年 FDA 执行的检查数量仍然有限,而且执行的检查大多也是针对关键任务,涵盖面有限。所以...
|

|
免费线上讲座:如何准备生物原液(DS)的 FDA 检查
2021.10.20
link=13px
【识林】如何准备生物原液(DS)的 FDA 检查 2021.10
w640h400acenter
国内生物创新药的蓬勃发展,持续稳定的为患者提供质量可靠的产品是最终目标,尤其对尝试国际市场的创新药,FDA 检查是关键环节。识林联合 IPEM 教育项目,邀请 FDA 无菌指南主要作者,微...
|

|
问题收集:FDA 的现场检查和 PDUFA
2021.10.09
10 月 20 日,IPEM 教育项目将邀请 FDA 中国办公室的代理助理主任 Juliette Taylor(朱丽叶·泰勒)和 FDA 中国办公室负责检查的副主任 Jonathan Chapman(柴俊),与 IPEM 师生围绕 FDA 的现场检查和 PDUFA 开展现场交流,若想了解:
FDA 对中国企业的近期检查计划
...
|

|
2021 财年远程场地评估方法推动 FDA 大部分执法行...
2021.10.08
随着疫情期间进行的远程记录审查开始在警告信中占据越来越大的份额,专家建议行业为美国 FDA 的远程监督做好准备,即使在例行的现场检查恢复和疫情结束后也可能会继续进行远程监督。
过去仅依靠现场检查作为药物掺杂警告信基础的 FDA,在 2021 财年的前 11 个月发出的警告信中,只...
|
|
ISPE 会上关于数据可靠性、欧盟无菌附录以及常见 GM...
2021.09.29
国际制药工程协会(ISPE)9 月 24 日举办的生物技术会议和研讨会的一个小组讨论会上,澳大利亚监管机构检查负责人分享了有关数据可靠性、欧盟 GMP 附录 1,以及影响受监管制药行业的其它问题的看法。
数据可靠性问题
在小组讨论上,监管机构被要求评论虚拟审计如何影响他们在...
|

|
FDA 蛋白原液生产企业检查清单摘录
2021.09.02
前日识林介绍了美国 FDA 最新发布的合规项目指南手册《CPGM 7356.002M 蛋白质原液生产企业监督检查》的一些重点内容。【FDA 发布蛋白原液生产企业监督检查指南手册】今天我们来看看这篇手册中非常重要的一部分内容 — 附件 A:蛋白原液的监督检查考量因素,也就是我们常说的检查...
|

|
FDA 明确表示尚无恢复国外现场检查的计划
2021.08.27
美国 FDA 表示目前没有计划恢复对在新冠(COVID-19)公共卫生紧急情况期间不被视为“关键任务”的操作进行国外现场检查。相反,FDA 继续依赖扩大使用互认协议作为现场检查的替代工具。
FDA 监管事务办公室(ORA)药品质量运营总监 Alonza Cruse 在 8 月 25 日药品审评与研究中...
|

|
FDA 疫情期间对印度公司的检查情况如何?
2021.08.26
美国 FDA 现场检查时间表的不确定性是印度药企第一季度财报会上反复讨论的话题。从 2021 年 2 月到 2021 年 8 月,FDA 在印度进行了七次药品检查。我们通过一些印度企业的财报电话会看看当前检查的开展情况以及印度药企对检查的期待。
FDA 表示,鉴于疫情的不确定性,FDA ...
|

|
【全文翻译】FDA 2020 财年药品质量状况报告
2021.08.19
美国 FDA 药品质量办公室(OPQ)于 8 月 17 日发布 2020 财年《药品质量状况》报告,这是 OPQ 连续第三年发布这一报告,“报告总结制药行业向美国患者和消费者提供优质药品能力的关键指标”。识林对报告内容做了全文翻译,供大家阅览。
FDA 在报告中指出,“我们在此报告...
|

|
礼来最新 483 揭露新冠抗体工厂生产质量问题
2021.08.17
美国 FDA 于 8 月 12 日公布了向礼来位于印第安纳波利斯的无菌注射剂生产场地发布的 483 报告,指出存在多项质量问题。
这些观察项是在 2021 年 2 月至 3 月间现场检查之后得出的,这次检查涉及在该工厂生产的多种药物:用于新冠的 bamlanivimab 和 etesevimab、用于...
|

|
FDA 面临国会重重压力,国外检查重启在即?
2021.07.30
美国 FDA 于本月早些时候在美国重新开始了检查, 让 FDA 有机会解决在疫情期间积压的大量国内检查。但是国外检查呢?去年 3 月至 10 月,FDA 仅执行了 3 次国外检查。美国国会议员希望知道 FDA 何时可以恢复正常的检查行动,尤其是在海外的检查行动。
美国众议院能源与...
|

|
FDA 2022 财年中国和印度突击检查试点将获更多财政...
2021.07.09
美国国会持续敦促 FDA 提高其检查范围和能力,而不是依赖替代工具。
众议院拨款委员会批准再次增加用于 2022 财年检查的资金,并明确表示,FDA 最好派工作人员亲自进行国外现场检查。拨款法案随附的报告中明确指出,“物理检查,尤其是在未经通知的情况下进行的现场检查,是 FDA...
|

|
欧盟公布 API 生产商实时远程 GMP 检查试点结果
2021.07.07
欧洲药品质量管理局(EDQM)于 7 月 2 日宣布了其实时远程检查(Real-Time Remote Inspections,RTEMIS)试点计划的经验和结论。该试点计划结合了实时视频,将检查员和原料药(API)生产场地连接起来,并对文件来源进行审查。试点计划的目的是监测生产场地的 GMP 合规情况和欧洲...
|

|
礼来内部调查报告称没有向 FDA 做出虚假陈述
2021.06.15
据路透社上周报道,根据 5 月 20 日礼来公司 Branchburg 工厂负责人发给员工的一份内部备忘录称,礼来的独立外部法律顾问调查得出结论,“礼来向 FDA 做出虚假陈述的指控没有得到证实。”
备忘录的结论与礼来 Branchburg 工厂工人最初提出的指控不同。根据此前爆出的一份内部...
|
|
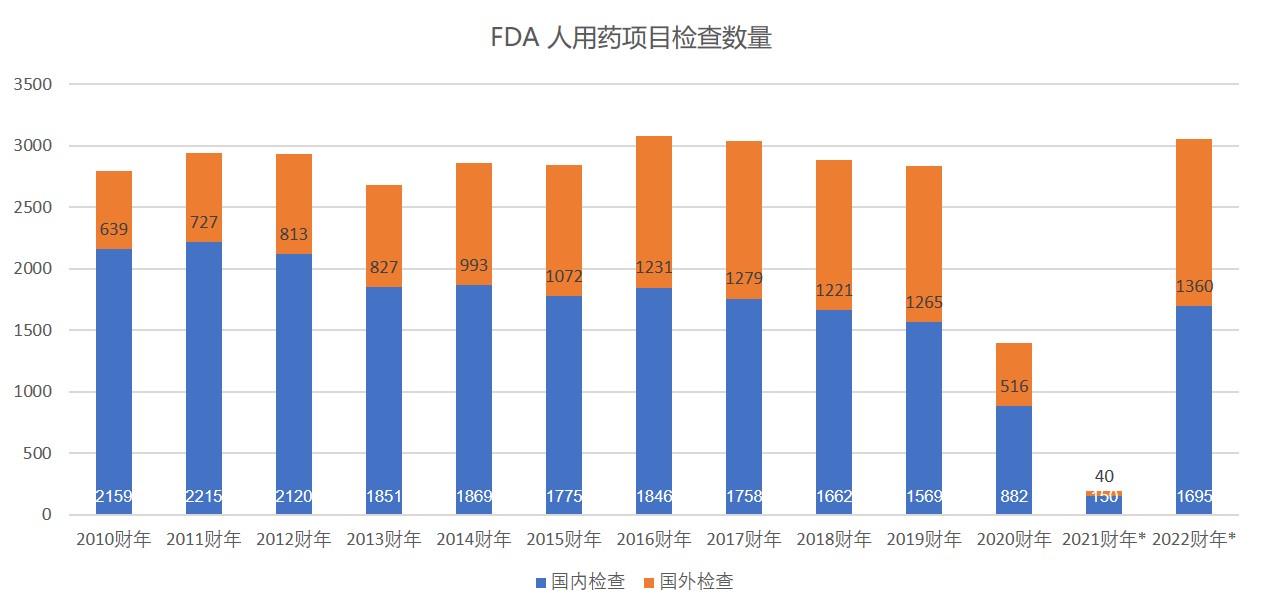
FDA 2022 财年预算申请再加码,为检查计划要人要钱...
2021.06.04
美国 FDA 的药品生产设施检查预计将在 2022 财年大幅增加至更正常的水平,但可能需要额外资金来应对新冠疫情造成的积压。
FDA 在 2022 财年总共申请了 65.3 亿美元,包括 36.1 美元的预算授权和 29.2 亿美元的使用者付费收入。总额比国会为 2021 财年颁布的预算总额增加 ...
|