
|
FDA 将公开讨论真实世界数据和证据在监管决策中的使...
2017.07.31
美国 FDA 于 7 月 31 日在https//www.federalregister.gov/documents/2017/07/31/2017-16021/developing-a-framework-for-regulatory-use-of-real-world-evidence-public-workshop 联邦公报上宣布将于 2017 年 9 月 12 日举行公开研讨会讨论真实世界数据(real-worl...
|

|
WHO 就生物类似药预认证启动试点征询意见
2017.07.29
世界卫生组织(WHO)正在推行其生物类似药预认证计划,从包括两种抗癌药的试点项目开始启动。WHO 已经制定了两种评估路径来预认证生物类似药,两种评估路径取决于这些产品是否已经获得严格监管机构的批准。在试点阶段,将免除与预认证相关的费用。
作为于 9 月份启动的试点项目的一部分...
|

|
患者代表 — 将患者的声音带到 FDA
2017.07.28
编者按:新药批准的关键是权衡疗效获益和安全风险。专家委员会投票表决的问题常是针对此权衡的,而且这些问题并非只有专家才能看𢤦。既然患者是最终的获益者和风险承受者,权衡决定中理应有患者的话语权。问题是,这个似乎是显而易见的作法,为何FDA直到最近才采用呢?难道这背后还有什...
|

|
FDA发布关于GDUFA自我认定及其它重要问题的问答指南
2017.07.26
美国 FDA 于 7 月 25 日发布了一份更新的问答指南《2012 仿制药使用者付费修正案:关于自我认定、仿制药申报审评、检查与合规的问答》。这份文件提供了 FDA 对 GDUFA I 期实施期间工业界提出的许多问题的答复。
自我认定
“自我认定”部分包含了谁需要自我认定,必须何时...
|
|
FDA Hatch-Waxman 公开会议情况报告 - II
2017.07.20
7 月 18 日 美国 FDA 召开备受瞩目的公开会议“施行 Hatch-Waxman 修正案:确保创新与可及之间的平衡”。我们在昨天的资讯中介绍了会议的整体情况【FDA Hatch-Waxman 公开会议和药品竞争行动计划进展 - I 2017/0719】,今天让我们来看看 FDA 仿制药办公室(OGD)前代理副主任...
|

|
FDA Hatch-Waxman 公开会议和药品竞争行动计划进展...
2017.07.19
2017 年 7 月 18 日,美国 FDA 举行了一场备受期待的公开会议,讨论药品竞争与创新之间的平衡。会议名称为“https//www.fda.gov/Drugs/NewsEvents/ucm563986.htm 施行 Hatch-Waxman 修正案:确保创新与可及之间的平衡”,会议得到了来自工业界以及数十个非 FDA 或 F...
|

|
FDA发布又一波BE指南修订 - 来自企业的反应
2017.07.18
2017 年 7 月 13 日 美国 FDA 再次新发布了 21 篇具体产品的 BE 指南,修订 13 篇。这是本财年第四次 FDA 批量发布和修订 BE 指南。之前我们曾经讨论过新发布和修订 BE 指南对企业的潜在影响,对于未决申请或尚未提交 ANDA 的已研发产品可能不得不根据新要求重复进...
|

|
IPEM2017届毕业典礼顾孝诚讲座:如何做好文职人员
2017.07.17
古丽(Leigh Verbois)博士
美国FDA驻华办主任
2017年7月8日
【编者按】在美国,Civil Servant 与 Public Servant 不同,前者可译为文职人员,后者为公职人员也称公务员。史上Civil(文职)是用来区别Military(军职),但现在文职人员一般是指特殊的公职人员,特殊在...
|

|
美国和欧盟提议罕见儿科疾病多公司多产品临床试验的可...
2017.07.16
根据美国和欧盟监管机构的共同提案,儿童罕见疾病药品开发商应考虑在多公司、多产品研究中测试产品的可能性。这项提案于 7 月 3 日发布,旨在促进罕见儿科疾病药品的开发,这一领域可以参加试验的患者量非常少。
FDA 和 EMA 表示,药品申办人还应更好地利用外推临床资料。他们应...
|
|
最近两项科学进步为FDA精准医疗带来令人鼓舞的未来
2017.07.13
(译自FDA Voice https//blogs.fda.gov/fdavoice/index.php/2017/07/two-recent-scientific-advances-underscore-an-encouraging-future-for-precision-medicine-at-fda/ “Two Recent Scientific Advances Underscore an Encouraging Future for Precision Medicin...
|
|
首个CAR-T细胞疗法获FDA专家会审一致通过
2017.07.12
诺华公司的突破性嵌合抗原受体T细胞疗法(CAR-T)于 7 月 12 日获美国FDA 咨询专家委员会的一致投票(10-0)支持批准。这一投票标志着这类实验性治疗的关键里程碑。FDA 预计将于 10 月 3 日做出最终批准决定。宾夕法尼亚大学科学家、领导这一领域药物开发的 Carl June 医师...
|
|
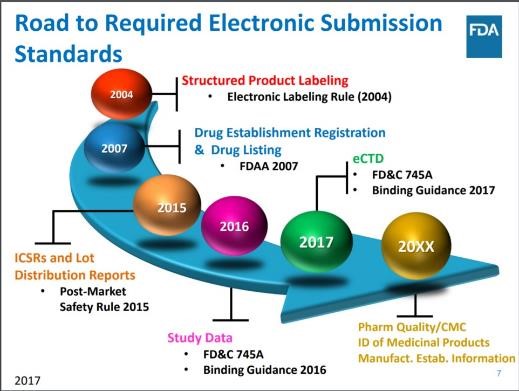
FDA希望标准化PQ-CMC数据和术语
2017.07.11
美国 FDA 于 7 月 10 日表示正在起草和征询关于使用标准化药品质量/化学制造和控制(PQ/CMC)数据元素用于电子提交的意见。
FDA 正在考虑作为 HL7(Health Level 7)结构化产品标签(SPL)文件实施 PQ/CMC 要求,表示,标准化 PQ/CMC 数据元素和术语的举措将提高药品...
|

|
FDA 计划如何帮助消费者利用科学进步
2017.07.10
(译自FDA Voice https//blogs.fda.gov/fdavoice/index.php/2017/07/how-fda-plans-to-help-consumers-capitalize-on-advances-in-science/ “How FDA Plans to Help Consumers Capitalize on Advances in Science” 2017 年 7 月 7 日,作者:Scott Got...
|

|
北京大学国际药物工程管理(IPEM)硕士2017届学位授予...
2017.07.09
“制药是由好人从事的事业”
—北京大学国际药物工程管理(IPEM)硕士2017届学位授予仪式
2017年7月8日,北京大学国际药物工程管理(International Pharmaceutical Engineering Management,IPEM)硕士项目2017届学位授予仪式在北京大学中关新园科学报告厅举行。
仪式由IP...
|

|
FDA在新英格兰医学杂志上发表关于临床试验主方案的述...
2017.07.07
美国 FDA 继续推动临床试验设计方面的创新,并在新英格兰医学杂志(NEJM)上发表关于主方案(master protocols)的述评《研究多种治疗药物、多种疾病或两者皆有的主方案(Master Protocols to Study Multiple Therapies, Multiple Diseases, or Both)》,强调了 FDA 对使...
|
|
FDA 局长近期扫除仿制药批准障碍的三项举措
2017.07.04
美国特朗普总统的新任 FDA 局长 Scott Gottleib 医师正在拉开解决诸如孤儿药认定积压、努力启动《药品质量与安全保障法案》要求的落实、阿片类药物流行以及最重要的减少仿制药竞争障碍的序幕。在 6 月 21 日的博客中,Gottlieb 局长以下面的话开篇:
“太多患者因药价太高...
|

|
FDA预计将在两年内批准可互换生物类似药
2017.07.01
美国生物类似药上市一直很慢,生物类似药路径于 2010 年创立,而到现在为止仅有五个生物类似药获得 FDA 批准,其中没有被批准为可互换的生物类似药。尽管 FDA 由于保密问题无法透露哪些申请已经提交到 FDA,但 FDA 生物类似药领导 Leah Christl 上周在芝加哥举行的 DIA 年会...
|

|
FDA 公布消除孤儿药认定积压的计划
2017.06.30
6 月 29 日,美国 FDA 公布了一项战略计划,用以消除 FDA 现有的孤儿药认定请求积压,并确保继续在严格截止日期下及时回应所有新认定请求。FDA 的孤儿药现代化计划于 FDA 局长 Scott Gottlieb 在参议院小组委员会听证会中做出在 90 天内消除积压并在请求接收后 90 天内回...
|

|
GDUFA I 实施核查:审评时间下降但FDA需对结余费用...
2017.06.29
美国审计总署(GAO)本周发布了一篇题为《仿制药使用者付费:申请审评时间下降,但 FDA 应制定计划管理未支配的使用者付费》计划;(2) 阐述了 FDA 对仿制药申请审评过程的改进;(3) 分析了仿制药申请审评时间的变化。在报告附录中,GAO 还包括了对 GDUFA 资助的并在 GDUFA ...
|
|
FDA 将更多仿制药列入优先审评并提供缺少竞争的仿制...
2017.06.28
6 月 27 日,美国 FDA 颁布两项重要举措增加仿制药竞争,帮助低价仿制药进入市场:一是发布无已获批仿制药的专利到期、专营期到期品牌药清单,二是再次修订 ANDA 审评优先级程序政策手册。
这些行动是 FDA 局长 Scott Gottlieb 于今年五月末宣布的“药品竞争行动计划”中首先采取...
|