
|
美国国防部药品供应链风险报告强调海外产原料药风险
2024.03.20
美国一个两党参议院小组于 3 月 19 日公布了一封写给国防部长的信,要求其改善供应链安全,以尽量减少药品短缺,并减少对海外,尤其是中国生产的药品的依赖。
根据与信件一起公布的《国防部药品供应链风险报告》 (API)的中国制药商,要么来源不明。但根据报告,使用中国产 API ...
|

|
FDA检查员举例分析
2023.05.31
2023年5月24日,识林联合北京大学知识工程与监管科学实验室,在浙江省药品监督管理局的指导以及台州市局的支持下,在台州举办了“《药品GMP指南》(原料药和质量控制实验室与物料系统分册)研讨交流会”。
在本次研讨会中,识林知识平台研究员,药品GMP指南(第2版)项目课题组王国旭博...
|

|
中国原料药企业常见检查缺陷分析
2023.05.30
2023年5月24日,识林联合北京大学知识工程与监管科学实验室,在浙江省药品监督管理局的指导以及台州市局的支持下,在台州举办了“《药品GMP指南》(原料药和质量控制实验室与物料系统分册)研讨交流会”。
在本次研讨会中,识林知识平台研究员,药品GMP指南(第2版)项目课题组王国旭博...
|

|
原料药企业的FDA检查缺陷研究专题报告(二)
2023.05.29
2023年5月24日,识林联合北京大学知识工程与监管科学实验室,在浙江省药品监督管理局的指导以及台州市局的支持下,在台州举办了“《药品GMP指南》(原料药和质量控制实验室与物料系统分册)研讨交流会”。
在本次研讨会中,识林知识平台研究员,药品GMP指南(第2版)项目课题组王国旭博...
|

|
原料药和QC物料指南浙江研讨会简报
2023.05.25
2023年5月24日,识林联合北京大学知识工程与监管科学实验室,在浙江省药监局的指导以及台州市市场监管局的支持下,在台州举办了“《药品GMP指南》(第2版)原料药和质量控制实验室与物料系统分册研讨交流会”。浙江省局、台州市局的监管人员,及浙江省内110余家药品生产企业近200位生产质...
|

|
原料药企业的FDA检查缺陷研究专题报告(一)
2023.05.25
2023年5月24日,识林联合北京大学知识工程与监管科学实验室,在浙江省药品监督管理局的指导以及台州市局的支持下,在台州举办了“《药品GMP指南》(原料药和质量控制实验室与物料系统分册)研讨交流会”。
在本次研讨会中,识林知识平台研究员,药品GMP指南(第2版)项目课题组王国旭博...
|

|
美国国会议员提出法案限制中国原料药进口
2020.03.21
3 月 19 日,美国参议院银行委员会经济政策分会主席、参议院情报委员会和军事委员会成员 Tom Cotton 和众议院军事委员会和交通基建委员会成员 Mark Gallagher 正式在参议院财政委员会提出一项法案,旨在终止美国对中国原料药的依赖。虽然该法案刚刚进入美国立法程序的第一步,后...
|

|
FDA 警告信数量增加时间缩短,原料药商应注意三大趋...
2019.11.07
美国 FDA 药品审评与研究中心(CDER)合规办公室主任 Donald Ashley 于 11 月 5 日在普享药协会(AAM)会议上对原料药(API)商提出了几项主要关切,指出了与供应链信息混淆、越来越多的数据可靠性问题以及导致召回的杂质问题相关的三大趋势。这些趋势基本与之前的报告类似,详见【FD...
|

|
FDA 再发警告信敦促再包装商披露原料药供应商
2019.10.02
美国 FDA 最近向重庆伊诺生化制品公司发出的警告信是 FDA 为保护美国患者免受药品供应链不透明带来的某些质量风险而采取的一系列行动中的最新动作。FDA 药品审评与研究中心(CDER)生产质量办公室(OMQ)主任 Francis Godwin 表示,这项工作正在使供应链更加透明,但仍需继续保持...
|

|
FDA 连发警告信加强对原料药再包装商的监管
2019.07.05
从最近分别签发给三家原料药再包装商的警告信中,美国 FDA 对供应链透明度的担忧可见一斑。三家再包装商都未能向其客户披露原料药原始生产商的名称,这种做法曾是原料药行业的常见操作,但 FDA 现在希望叫停这种做法。
这三家再包装商均位于美国境内,分别是科罗拉多州 Englewood ...
|
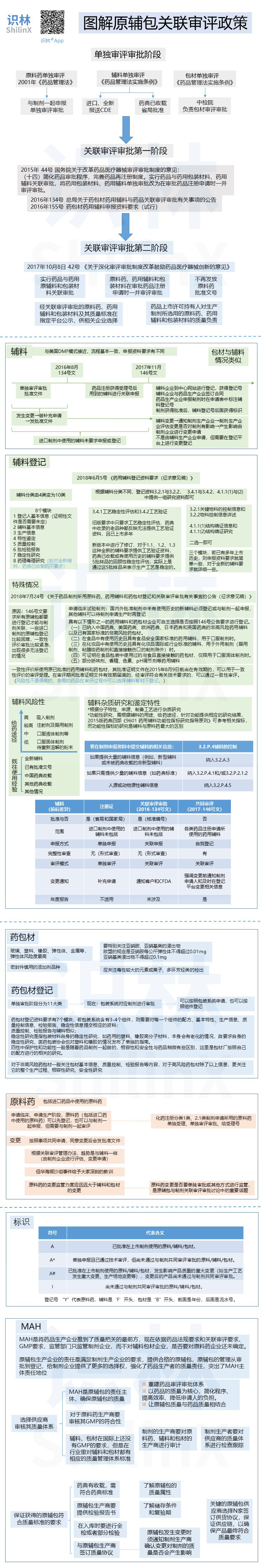
|
图解原辅包关联审评政策
2018.10.13
作者:识林-樟
识林®版权所有,未经许可不得转载。如需使用请联系 admin@shilinx.com 。
...
|

|
FDA新发布原料药GMP问答指南与ICH一致
2018.04.23
上周,美国FDA公布了题为“原料药GMP问答”的指南。尽管与ICH 2015版的Q7问答指南存在200多处差异,但基本是大小写、标点、用词习惯、拼写习惯、法规环境造成的差异,实质内容一致。继适用了ICH Q7指南之后,FDA在法规一致化上再进一步,通过适用本问答指南澄清国内外企业在实施IC...
|

|
FDA启动供应链安保试点
2013.08.20
申请时间2013年9月16日-2013年12月31日;实施时间,2014年2月-2016年2月
Notice to Industry FDA Launches Secure Supply Chain Pilot Program
Notice issued August 20, 2013
FDA today published a Federal Register notice announcing the launch of the Secure Suppl...
|

|
欧盟免除FDA出口证明
2013.06.21
概述
欧盟免除FDA为美制药企业出口欧洲出具证明,此外还有澳大利亚、日本、瑞士
背景是欧盟将于2013年7月1日生效的防止药品掺杂的62号令
FDA于2013年1月提出被欧盟"listed"的申请在2013年5月13-20日对FDA监管法规和现场检查的审计结束后被通过
For Immediate Release June 21, 2013
...
|

|
印度促进药品出口新战略
2013.06.14
印度公布促进药品出口新战略
印度宣布了一项旨在促进药品出口的短期策略,并制定了针对印度国内的制药企业的指南,以遵守欧盟对出口到欧洲的原料药的指令。
推出这项鼓励药品出口的新计划,原因在于印度政府担心用美元结算的增长步伐放慢。根据印度工商部属下的印度药品出口促进会(th...
|

|
EMA关于GMP的问答
2013.06.01
EU GMP part II Basic requirements for active substances used as starting materials GMP compliance for active substances - UPDATED
8.During inspections, why do inspectors sometimes ask to see reports of audits of active substance manufacturers carried...
|

|
欧盟原料药证明文件
2013.05.07
国家食品药品监督管理总局关于出口欧盟原料药证明文件有关事项的通知
食药监〔2013〕10号
国家食品药品监督管理总局
2013年05月07日 发布
各省、自治区、直辖市食品药品监督管理局(药品监督管理局):
2011年6月欧盟发布了原料药新指令2011-62-EU,要求对进...
|

|
EMA参照活性物质有关的新活性物质考虑要点意见书
2012.12.06
为协调一致,EMA与2012年10月18日发布指定单一立体异构晶型(对映体)、配合物、衍生物、或是不同盐或酯与相关的参照活性物质有关的新活性物质的考虑要点的意见书(Reflection paper on consideration given to designation of a single stereo isometric form (enantiomer), a compl...
|

|
加拿大卫生部宣布原料药生产将需符合GMP标准
2012.11.16
加拿大卫生部于2012年11月13日在官方网站上发布声明,称将对药品生产采取更严格的监管措施,措施之一是药品活性成分(AI)的生产也必须符合药品生产 GMP标准,这里的AI包括所有在加拿大境内销售的药品的AI,无论其是否在加拿大境内生产。
原文链接
Currently in Canada, internationall...
|

|
欧盟发布62号令补充文件
2012.10.31
欧盟于10月26日发布了与62号令相关的一些文件,包括第三方出口国的书面确认模板、相关问题解答Q&A、关于此进口API原料新规定的宣传资料、以及信息提供清单。以下为原文及链接:
Importation of active substances
Directive 2011/62/EU (968 KB) of the European Parliament and ...
|