
|
【识林向导招新 2026】分享知识,获取账号,共建识林...
2026.03.07
Hi,亲爱的识林用户
识林基于药业结构化专业知识库,结合AI技术,提供全球药业监管及产业实践解决方案的一站式服务。
识林社区是依托于知识库的专业知识交流平台,有问有答有探讨,并且向所有用户开放。
识林向导来自药企一线,基于所学知识和丰富经验,回答问题分享心得,帮助识...
|

|
适配 Q9 和 Q12,FDA 拟全面修订 SUPAC 系列指...
2026.03.06
3月3日,FDA发布联邦公告,就“工艺放大和批准后变更”(SUPAC)系列指南文件的修订征求公众反馈,旨在评估其与ICH《Q9(R1):质量风险管理》指南以及关于批准后变更的《Q12:药品生命周期管理的技术和监管考虑》指南的适配性,解决潜在的冲突或覆盖问题。
此次征求意见的通知共涉及...
|

|
FDA 拟澄清新临床研究3年专营权,改良药仍有机会
2026.03.06
3月3日,FDA发布了一份题为《药品的新临床研究专营权(3年专营权):问答》的指南草案,澄清药品申办者获得3年市场专营权的具体要求,旨在鼓励已获批药品的生命周期管理,涵盖新适应症、剂型、规格及给药方案的保护。
这份14页的指南草案以问答形式呈现,共包含18个问题。内容与业界...
|

|
欧盟新药法引入“平台上市许可”和“平台主文件”
2026.03.05
欧盟新药品立法已步入最后阶段,预计将于2026年内正式获得采纳并开启两年过渡期。此次立法修订被视作过去二十余年来欧盟制药行业监管框架最重大的变革。
根据欧盟委员会近日披露的信息,新框架将引入两种新的监管路径,以更灵活、创新的方式管理平台技术。这两种路径分别为平台上市许可...
|

|
聚焦 AI 与药品监管:HMA-EMA 小组召开行业利益相...
2026.03.05
2月4日,由欧洲药品管理局(EMA)和药品机构负责人(HMA)联合成立的人工智能(AI)行业利益相关者小组举行了线上会议。本次会议旨在促进监管机构与行业之间的开放对话,讨论AI在整个药品生命周期中的应用。会议介绍了国际AI指导原则的合作进展,探讨了《生物技术法案》对未来AI监管框架...
|

|
FDA 应用监管科学处聚焦新方法学(NAM)替代动物试验
2026.03.04
2月25日,FDA发布《应用监管科学处2025年度报告》,作为隶属于转化科学办公室(OTS)临床药理学办公室(OCP)的核心科学部门,应用监管科学处(DARS)在2025年度聚焦于新方法学(NAM)的开发与应用,在心脏/肺部NAM模型、罕见变异体及药物组合评估等领域取得系列进展,并为药品审评提供...
|

|
EMA 定稿非致突变杂质控制策略,补充 ICH Q3 并推进...
2026.03.04
征求意见1年后,EMA于2月2日正式发布《关于非致突变杂质的界定的思考性文件》,为非致突变杂质(Non-Mutagenic Impurities, NMI)的控制提供了详尽的参考框架,补充了ICH Q3A和Q3B指南在药品上市后出现超标杂质的监管缺口,并明确倡导采用新方法学(New Approach Methodologies, ...
|

|
多年酝酿后,美国医院和医生名录预计于年内上线
2026.03.03
据STAT独家报道,美国联邦政府近日披露,酝酿多年的“国家医疗提供者目录”(National Provider Directory)将在今年晚些时候进入初步测试阶段。
这一信息隐藏在医疗保险和医疗补助服务中心(Centers for Medicare and Medicaid Services,CMS)针对医疗保险优势计划(Medicare Adv...
|

|
EFPIA 比较10国生物制药战略,中美成欧洲标杆
2026.03.03
欧洲制药工业协会联合会(EFPIA)近期发布了一份题为《10个国家生物制药战略的比较分析》的报告。该报告在审视欧洲当前面临的地缘政治与经济压力背景下,对比分析了全球10个国家在生物制药领域的支持政策与战略布局。报告指出,生物制药行业与人工智能(AI)、量子技术同属全球创新与工...
|

|
国际药政每周概要:FDA“合理路径”机制指南,CDER ...
2026.03.03
【非临床与临床研究】
2.23,【FDA】关于利用合理机制框架开发针对生物学原因已知的特定遗传疾病的个体化治疗的考量
【药学研究】
2.26,【FDA】BE 指南 新增31篇,修订67篇
本周BE指南:
【生产质量】
本周 483和警告信
【监管综合】
2.24,【FDA】CDER 指...
|

|
IPEM 课程 2026无菌保证系列:第一、二课
2026.03.02
无菌保证系列:第一、二课
授课老师:尹放东、苏虹
上课日期:3月7-10日(周六 - 二)
授课方式:中文
上课教室:上海
无菌保证不是单一的技术问题,而是涉及无菌制造的所有相关系统:产品、工艺、方法、厂房、设施、设备、物料、人员、运输、贮存和使用,并贯穿每一...
|

|
CNPV 一拒一批,FDA 拟发“提前”审评奖金
2026.03.02
FDA近期对纳入“局长国家优先审评券(CNPV)”项目的两项药品申请公布了审评决定,揭示了该特殊快速审评通道的不同走向。
Disc Medicine公司的Bitopertin用于治疗红细胞生成性原卟啉症(EPP)的申请收到了完全回应函(CRL),未能获得加速批准。而勃林格殷格翰(Boehringer Ingelheim...
|

|
国内药政每周导读:检查整改报告模板,全球新药获益风...
2026.03.02
【非临床和临床研究】
2.24,【CDE】关于发布《新药全球同步研发中基于多区域临床试验数据进行获益-风险评估的指导原则(试行)》的通告(2026年第18号)
2.24,【卫健委】做好《生物医学新技术临床研究和临床转化应用管理条例》贯彻落实,高质量满足人民群众健康需求,支撑生...
|

|
【周末杂谈】从 Q1 Q2 终见天日,看仿制药的艰辛
2026.03.01
仿制药能立足,多亏FDA。但仿制药日子的艰难,也根于FDA。
上月初美国国会立法,允许FDA透露参比制剂辅料配方信息,以节约仿制药研发费用、加快上市速度、降低药价,造福百姓,赢得仿制药业一片称赞。但细读,可看出字里行间中的不满和担忧。
美国普享药协会(即仿制药协会)一边赞扬...
|

|
【直播预告】2026年2月全球法规月报划重点
2026.02.28
识林2026年2月报直播如期而至,并同步推出2月报。本次直播聚焦2月全球主要监管机构的重点法规,并挑选影响力较大的文件做重点简介。短短40分钟,轻量而轻松,旨在帮助大家回顾上个月的监管重点,加深理解或是查缺补漏。
月报获取渠道:
会员:关注直播当日(3月6日,周五)的【最近更...
|

|
【课程与会议】近期更新的重点课程和3-4月会议预告
2026.02.28
近期更新重点课程
识林升级版用户,可在PC端和App、小程序移动端学习57个模块的1000+门课程7000+节视频,涉及药品研发、注册、生产、质量等全生命周期,包括IPEM项目部分精华课程摘要,监管和学术机构专题教学和研讨会,及供应商技术介绍专业课程。除视频内搜索、收藏、评论功能外,...
|

|
时隔14年,PICS 和欧盟联合启动医用气体 GMP 修订
2026.02.27
2月11日,药品检查合作计划(PIC/S)与欧洲药品管理局(EMA)联合发布概念性文件,宣布启动GMP附录6"医用气体的生产"的修订工作。这是该附录自2010年采纳以来的首次重大更新。
PIC/S和EMA指出,新冠疫情期间医用氧气供应链的紧张局面暴露出现有监管框架的不足,促使监管机构重新...
|
|
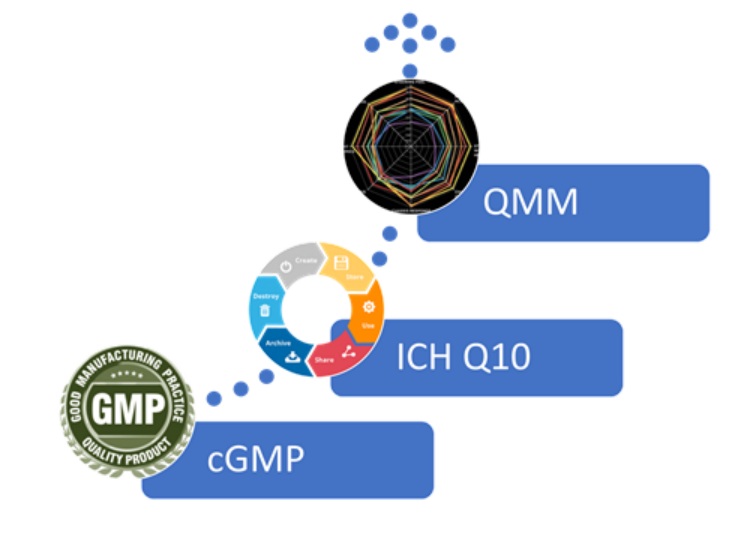
启动第三轮试点,FDA 质量管理成熟度评估工具仍在迭...
2026.02.27
2月11日,FDA药品审评与研究中心(CDER)宣布启动第三轮自愿性质量管理成熟度(QMM)原型评估方案评价计划,企业申请截止日期为2026年4月13日。试点企业准入要求与之前试点保持一致,核心要求是接受过检查且未收过警告信。
不是检查是合作,不是评价产品和设施而是评估文化
在2023年...
|

|
FDA 罕见儿科优先审评券展期至2029,独占期可“分享...
2026.02.26
2月4日,特朗普签署政府资金延期法案,包括重新授权FDA发放罕见儿科疾病优先审评券(Priority Review Voucher,PRV)的权力,有效期延续至2029年。
该计划曾于2024年底到期,重新授权已搁置超过一年。但FDA持续向在2024年12月计划到期前已获得罕见儿科疾病认定的公司发放PRV,2025...
|
|
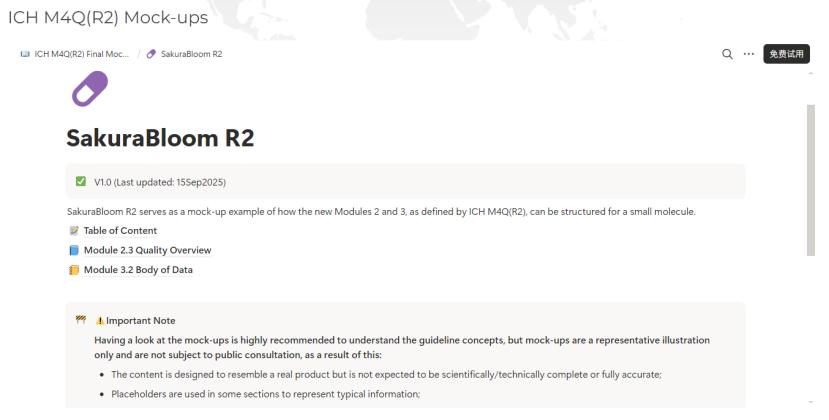
为诠释“新 CTD”,ICH 发布了一套详细的虚拟药物申...
2026.02.26
ICH于2026年2月13日发布了一套M4Q(R2)(“新CTD”)示例模板文件,旨在阐释修订后的通用技术文件(CTD)质量模块2.3和模块3的信息组织方式和潜在结构。
该示例模板基于一个虚构的名为Sakura Bloom R2的小分子药物,其API也有虚构的通用名Sakuramil。这些名称源自日文“樱花”(该A...
|