
|
英国 MHRA 发布指南对生物类似药比对研究要求减负
2020.09.30
英国药品与医疗保健产品监管机构(MHRA)发布了一篇生物类似药指南草案,旨在通过取消大多数情况下对于比对有效性试验的需求,减少对生物类似药提交的临床试验数据的需求。MHRA 提出,如果有足够的比对分析和功能性数据,通常就不认为需要进行比对有效性试验,因此对生物类似药的临床有效...
|

|
英国 MHRA 脱欧后转型之路,将启动新的创新药许可路...
2020.09.21
英国药品与医疗保健产品监管机构(MHRA)将于 2021 年 1 月 1 日对创新药启动新的许可路径,包括针对每种产品的“创新药品认定”和新的“目标开发概况”以作为创新药开发的路线图。
新路径设想通过“适应性许可”对新产品进行“有监督的早期使用”。新路径是英国新的综合监管框架...
|

|
MHRA 总结根源调查的常见问题并给出范例
2020.09.15
调查是任何制药商或批发商运营中不可避免的方面;尽管每个公司都在努力建立完善的系统和流程,但无法预测每种潜在的失败模式并且完全预防事件的发生。英国药品与医疗保健产品监管机构(MHRA)最新的一篇https//mhrainspectorate.blog.gov.uk/2020/09/14/a-fresh-look-at-an-old-topi...
|

|
MHRA 回顾共线生产中交叉污染控制的常见问题
2020.08.20
英国药品与医疗保健产品监管机构(MHRA)近日发布官方https//mhrainspectorate.blog.gov.uk/2020/08/18/cross-contamination-control-in-shared-facilities-and-equipment-reflection-on-common-deficiencies-and-expectations-as-seen-in-recent-pic-s-guidan...
|

|
英国 MHRA 远程药品 GMP 检查经验
2020.07.18
现场/远程混合检查或成新常态,远程检查不是万能药
英国药品与医疗保健产品监管机构(MHRA)正在借鉴以往病毒爆发的经验,推出了一项宏大的远程/现场混合检查计划,以帮助维持现有药品的供应并在 COVID-19 大流行旅行限制下批准新药,并且预计会在大流行结束以后成为新常态。
MHRA...
|
|
英国允许瑞德西韦以许可外用药的方式治疗新冠
2020.05.28
英国药监局给出了这项许可所基于的科学考量
英国药品与医疗保健产品监管机构(MHRA)于 5 月 26 日在早期获取药物计划(Early Access to Medicines Scheme,EAMS)下允许瑞德西韦用于治疗新型冠状病毒疾病(COVID-19)某些重症住院患者。
EAMS 于 2014 年首次推出,其目...
|

|
英国 MHRA 2018 GMP 检查缺陷趋势分析:数据总览
2020.05.26
英国药品与医疗保健产品监管机构(MHRA)于 2019 年 10 月发布了其在 2018 年的 GMP 检查缺陷,与前几年不同,2018 年 GMP 检查缺陷数据采用了电子表格的形式,公布了 6200 多行数据,人们可以根据自己的需要进行解析和呈现数据。而此前的 2015 年,MHRA 均是提供的约 10...
|

|
欧盟和英国在疫情期间放宽部分 GMP 要求
2020.04.27
鉴于新冠疫情(COVID-19)大流行带来的挑战,欧盟和英国药品监管机构(MHRA)均不同程度放宽了对 GMP 的解释,以保障疫情期间的药品供应。https//www.gov.uk/guidance/exceptional--flexibilities-for-medicines-manufacturers-during-the-coronavirus-covid-19-outbreak M...
|

|
适应性临床试验需更有效地管理和质量控制
2020.04.25
适应性临床试验有许多好处,但是需要有效地管理才能成功,在适用性试验设计中尝试新要素的公司应投入更多资源,以应对通常与此类研究相关的额外工作量,否则适应性试验最终可能会出问题。
英国药品监管机构(MHRA)GCP 资深检查员 Mandy Budwal-Jagait 在 2 月份 MHRA 主办的 G...
|

|
英国 MHRA 关注新冠疫情引发的临床试验相关偏差上升
2020.03.14
英国药品与医疗保健产品监管机构(MHRA)表示,由于新型冠状病毒肺炎(COVID-19)疫情爆发,预计正在开展的临床试验中与试验方案相关的偏差将会增加。世界卫生组织(WHO)于 3 月 11 日宣布 COVID-19 疫情为全球大流行(pandemic)。【WHO 宣布全球大流行,FDA 暂停境外检查和外部会议...
|
|
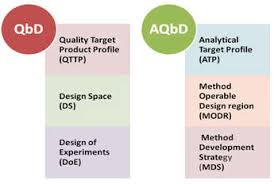
MHRA 分析质量源于设计(AQbD)问答
2019.08.23
本月末,英国药品与医疗保健产品监管机构(MHRA)就将分析质量源于设计(AQbD)原则应用于药典标准向公众的反馈意见征询期将截止。【英国 MHRA 就分析质量源于设计公开征询意见 2019/06/13】现在我们来跟随 MHRA 博客对英国药典的两位药典科学家 Stephen Maddocks 和 Peter Crow...
|

|
MHRA 对临床试验电子健康记录问题的GCP缺陷示例和建...
2019.08.07
本文是英国 MHRA 资深 GCP 检查员撰写的一篇有关用于临床试验目的的电子健康记录(EHR)的问题和建议,文中详细列举了在检查中发现的各类问题,并给出了一些改进原则和注意事项。无论对于临床机构还是申办人,都非常有帮助。
英国有一项国家医疗服务(NHS)计划,用电子健康记录(E...
|

|
MHRA 检查员强调对 QA 的重视并分享实验室关键检查...
2019.06.18
我们在昨天的资讯中介绍了英国药品与医疗保健产品监管机构(MHRA)GCP 和 GLP 资深检查员 Jason Wakelin-Smith 在今年 3 月举办的 MHRA 实验室研讨会上关于实验室数据可靠性实践问题的一些看法。【英国 MHRA 检查员关于实验室数据可靠性实践问题的评论 2019/06/17】今天我...
|

|
英国 MHRA 检查员关于实验室数据可靠性实践问题的评...
2019.06.17
英国药品与医疗保健产品监管机构(MHRA)资深检查员极力鼓励把数据工艺映射(data process mapping)作为规划、建立和维护数据可靠性(DI)所必需的控制措施的第一步。另外还就数据可靠性实践中的一些常见问题从检查员的视角给出了切实的答案。
虽然 DI 的概念并不新鲜,但现代可互...
|
|
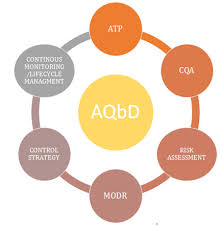
英国 MHRA 就分析质量源于设计公开征询意见
2019.06.13
英国药品与医疗保健产品监管机构(MHRA)于 6 月 4 日宣布计划将分析质量源于设计(AQbD)原则应用于药典标准,并向利益攸关方征询反馈意见pdf 。MHRA 认为采用 AQbD 原则能够提供“明显的附加获益”并且能够使英国药典中的分析方法框架“比目前更加健全和清晰”。
MHRA 发布...
|

|
英国监管机构对 GDP 场地试点远程检查计划
2019.04.25
英国药品与医疗保健产品监管机构(MHRA)于 4 月 16 日在其官方博客上宣布计划测试一种新方法,通过远程、非现场检查(office-based inspection)和风险评估,来检查企业对于药品经营质量管理规范(GDP)的符合性。MHRA 表示启动非现场评估和风险评价(Office Based Evaluation and Ris...
|

|
质量文化:从历史中学习
2019.03.11
(本文译自 MHRA Inspectorate Blog,作者:David Churchward,原文标题:Quality Culture Learning from History)
高级管理层领导和各级人员的承诺(换而言之,组织的‘质量文化’)是确保产品质量和供应连续性措施的基础。虽然在欧盟 GMP 第一章和 ICH Q10 等现行指南...
|

|
英国 MHRA 考虑对不合规场地收取额外检查费
2019.01.05
英国药品与医疗保健产品监管机构(MHRA)计划于今年引入额外费用,以支付与不合规相关的成本。额外费用将根据 MHRA 现有的非现场评估(office-based assessment)日费率收取。
与不合规案件相关的额外费用将覆盖所有类型的 GxP 检查。MHRA 检查部门经理 Richard Andrews 于 18 ...
|

|
FDA 与 MHRA 如何决定检查场地及检查频率
2018.12.13
美国 FDA 今年年初修改了其用于确定哪些国外或国内药品生产场地需要检查或需要其它类型的监督检查以及检查频率如何的方法。同时,FDA 还引入了一个多年期资源规划过程,使其能够更好地利用资源、规划产品抽样和检查频率。
FDA 药品审评与研究中心(CDER)药品质量办公室(OPQ)下属...
|

|
MHRA加强药物警戒,更加关注办公室检查
2018.05.29
英国药品监管机构正在探索如何将其药物警戒检查的重点放在高风险领域,并减少其在检查上花费的天数。为此,办公室检查(Office-Based Inspections, OBI)已经成为一个有用的概念,并且计划更加积极地使用这种方法。
英国药品和健康产品管理局(MHRA)声称其正在计划通过更多地...
|