|
诺华前雇员起诉称因揭露数据错误而被解雇
2020.03.10
诺华公司一名前雇员称她因指出诺华关于眼用药 Beovu 的不正确安全性数据而被开除。
Zuhal Butuner 在去年 2 月份提起的诉讼中描述了她曾在 2018 年 3 月建议诺华就有关 Beovu(brolucizumab)的已发布安全性数据中的“重大错误”发布新闻稿或向医生发信,Beovu 当时是正在...
|

|
临床前和临床阶段的数据可靠性问题日渐受关注
2020.02.13
近年来,药品生产领域的数据可靠性(data integrity)问题受到了广泛审查,包括对 GMP 违规的警告信和执法行动,但人们也越来越关注导致临床(GCP)和临床前(GLP)违规的数据可靠性问题。临床前和临床研究中的数据可靠性问题会危及药品研发计划,需要申办人的密切关注以及与 FDA 的...
|
|
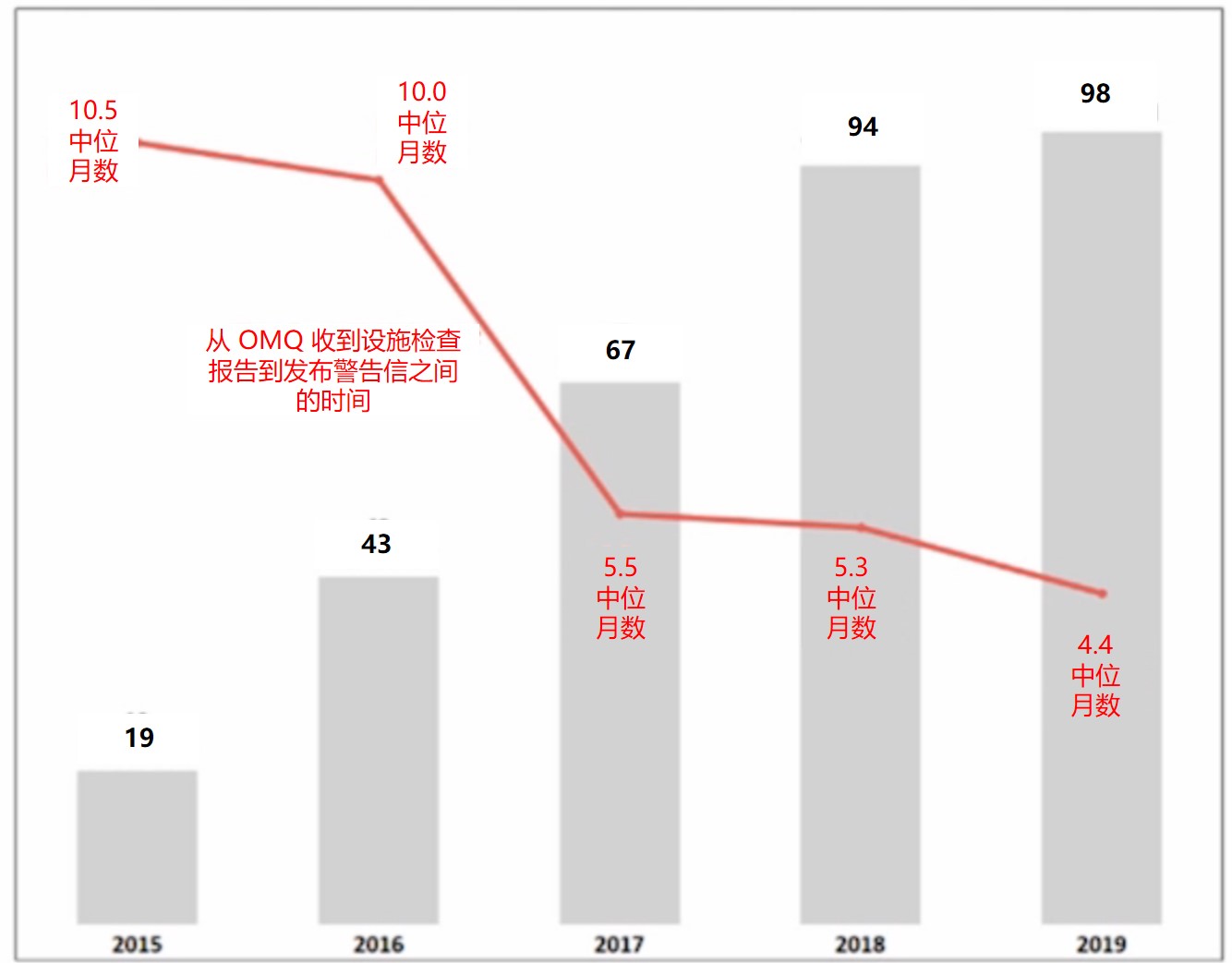
FDA 警告信数量增加时间缩短,原料药商应注意三大趋...
2019.11.07
美国 FDA 药品审评与研究中心(CDER)合规办公室主任 Donald Ashley 于 11 月 5 日在普享药协会(AAM)会议上对原料药(API)商提出了几项主要关切,指出了与供应链信息混淆、越来越多的数据可靠性问题以及导致召回的杂质问题相关的三大趋势。这些趋势基本与之前的报告类似,详见【FD...
|

|
FDA 公布诺华对数据操纵问题的 483 回复
2019.09.26
美国 FDA 于 9 月 24 日公布了 诺华公司在 8 月 23 日提交给 FDA 的有关其基因治疗药数据操纵问题的 483 回复。这份长达 59 页的回复函中指出,由于调查的“高度复杂”性而未能尽快将这一问题告知 FDA,并将问题责任归咎于两名 AveXis 高管。
诺华下属子公司 AveXis 公司...
|

|
FDA 公告对一家药商伪造文件的惩处
2019.08.22
美国 FDA 于 8 月 20 日在其新闻公告中表示向一家中国非处方药(OTC)制药商发出了一封警告信,内容涉及包括数据可靠性在内的 CGMP 违规行为。这是 FDA 不太常见地通过新闻公告和邮件订阅的形式公布其向某家公司发出警告信,宣传力度之大或许与公司所生产的产品性质有关,FDA ...
|
|
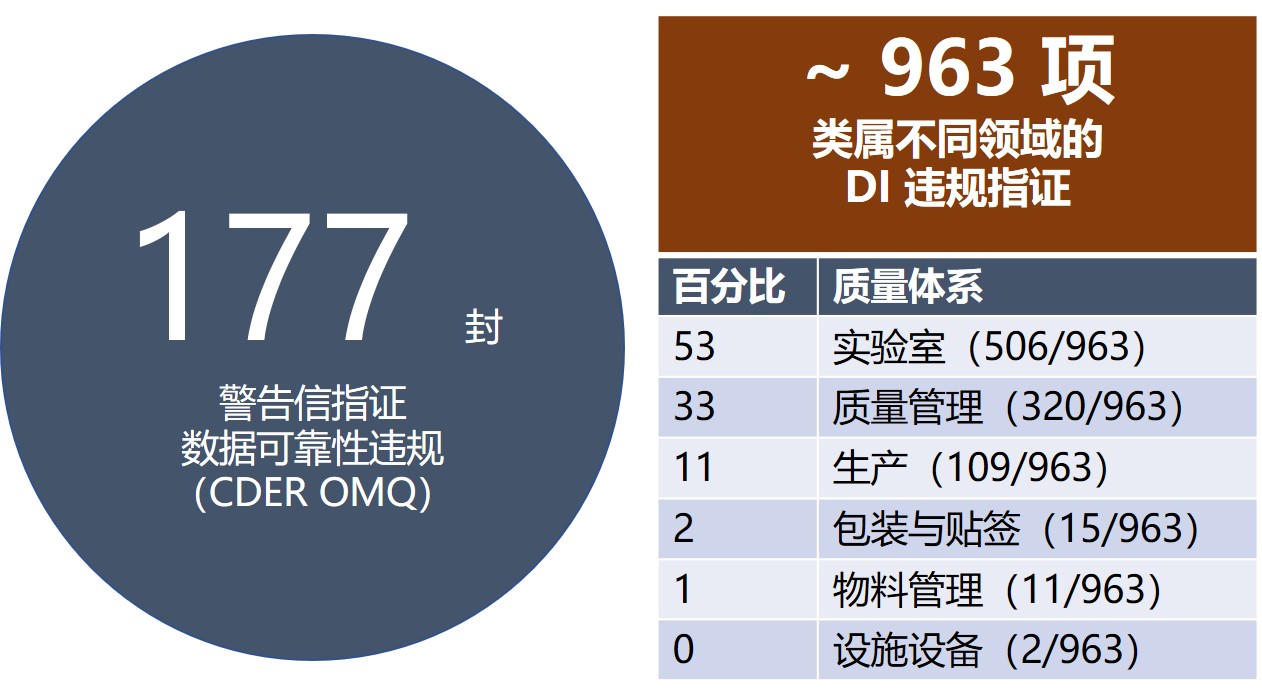
FDA 向国外发出的警告信四分之三涉数据可靠性
2019.08.13
昨天的资讯介绍了企业如何换个角度从监管视角审查自身问题,在监管检查之前发现隐藏的数据可靠性缺陷。今天我们从一些警告信观察项数据以及资深专业人士的建议来继续看看如何及早、高效的发现数据可靠性问题。
前 FDA 检查员、Parexel 咨询公司副总裁 Ron Tetzlaff 于 2019 年...
|

|
企业应从监管视角审查自身数据可靠性
2019.08.12
数据可靠性(data integrity, DI)监管合规专家观察到,行业内部和第三方审计人员通常不会发现数据可靠性失败,因为他们没有像 FDA 检查员那样查看系统和流程。即使在公司已经针对即将到来的检查执行了多次审计的情况下,监管机构也能识别出公司尚未发现或者尚未进行风险评估的 DI ...
|

|
诺华基因治疗药陷数据可靠性泥淖,知情迟报或加重问题...
2019.08.08
美国 FDA 严肃声明,诺华及其子公司 AveXis 公司可能会面临民事或刑事诉讼,不仅是因为操纵用于 Zolgensma 基因治疗药物批准的数据,更是因为公司在产品批准前就知道了这个问题但并没有向 FDA 披露。
FDA 生物制品审评与研究(CBER)主任 Peter Marks 在 8 月 6日的一份声...
|

|
从教训开始学习 – 看看回复483有哪些常犯的错
2019.08.06
是不是检查结果不好就会收到警告信呢?根据识林483数据库(即将上线,数据库收录了美国FDA 过去十年近50000条检查信息和6000多封483报告原文,还可提供检查员信息等迎检定制服务),官方行动指示(OAI)最终转化为警告信的比例近似为20%(考虑到检查结果的升级和降级,这个比例是假设FDA...
|

|
印度药业反击质量问题指责,兰伯西揭发者尖锐回应
2019.08.02
关于印度制药业数据可靠性和质量管理的问题,我们经常看到的是监管机构的视角,现在我们换个角度,从当事人的视角来看看,本文摘选整理了印度 Biocon 药业掌门人 Kiran Mazumdar Shaw 发表在印度媒体上的公开言论,以及原兰伯西(Ranbaxy)高级管理层、Ranbaxy 案件的揭发者 Dinesh ...
|

|
FDA 谈如何避免数据可靠性问题影响药品批准
2019.07.30
当美国 FDA 了解到其批准了基于可疑生产数据的药品时,后果可能会很严重,但如果公司保持冷静并采取 FDA 介绍的一些关键步骤,则结果可能会大不相同。
FDA 药品质量办公室工艺与设施办公室主管 Derek Smith 最近在加州圣地亚哥举行的药物信息协会(DIA)年会上的演讲概述这种情...
|
|
FDA在废品场发现GMP文件,印度药厂再陷数据可靠性漩涡
2019.07.19
美国公众与监管机构对于在亚洲生产的药品质量一直不能放心,最近一封涉及美国仿制药最大供应商之一 — Strides 药业的警告信再次说明了问题的严重性。
根据 FDA 本周在其网站上发布的 7 月 1 日的一封警告信,FDA 检查员在位于印度 Puducherry 的 Strides 工厂的废品场发...
|

|
Akorn 因根源调查不力再收 FDA 警告信
2019.07.12
美国 FDA 于 6 月 13 日发给 Akorn 公司的警告信中指证公司对杂质和瓶子缺陷问题执行了错误的根源调查,无菌操作不良以及对计算机设备控制不足。Akorn 的警告信显示了一种趋势,即,FDA 在企业超标(OOS)调查中发现越来越多的 GMP 违规行为,这一问题正有逐渐取代数据可靠性成为...
|

|
数据可靠性危机导致 Apotex 撤销 31 件已获批 AND...
2019.07.11
加拿大制药商 Apotex 公司因其在印度班加罗尔的两家工厂持续存在数据可靠性和质量部门失效问题,而要求撤销美国的 31 个获批仿制药申请。美国 FDA 于 7 月 10 日在联邦公报上发布撤销通告,并列出具体撤销名单。
Apotex 公司撤销仿制药申请的决定是近年来数据可靠性危机所...
|

|
2018 年指证数据可靠性问题的 FDA 警告信情况
2019.06.21
2018年FDA警告信中指证的数据可靠性缺陷
2018年FDA警告信中指证的数据可靠性失败中最为常见的违反法规的情况
过去11年中,指证存在数据可靠性缺陷的FDA警告信数量变化情况
过去11年中FDA警告信中指证的数据可靠性问题及趋势
企业可采取的防范、确定和改正问题的措施:高级管理层有责...
|

|
英国 MHRA 检查员关于实验室数据可靠性实践问题的评...
2019.06.17
英国药品与医疗保健产品监管机构(MHRA)资深检查员极力鼓励把数据工艺映射(data process mapping)作为规划、建立和维护数据可靠性(DI)所必需的控制措施的第一步。另外还就数据可靠性实践中的一些常见问题从检查员的视角给出了切实的答案。
虽然 DI 的概念并不新鲜,但现代可互...
|
|
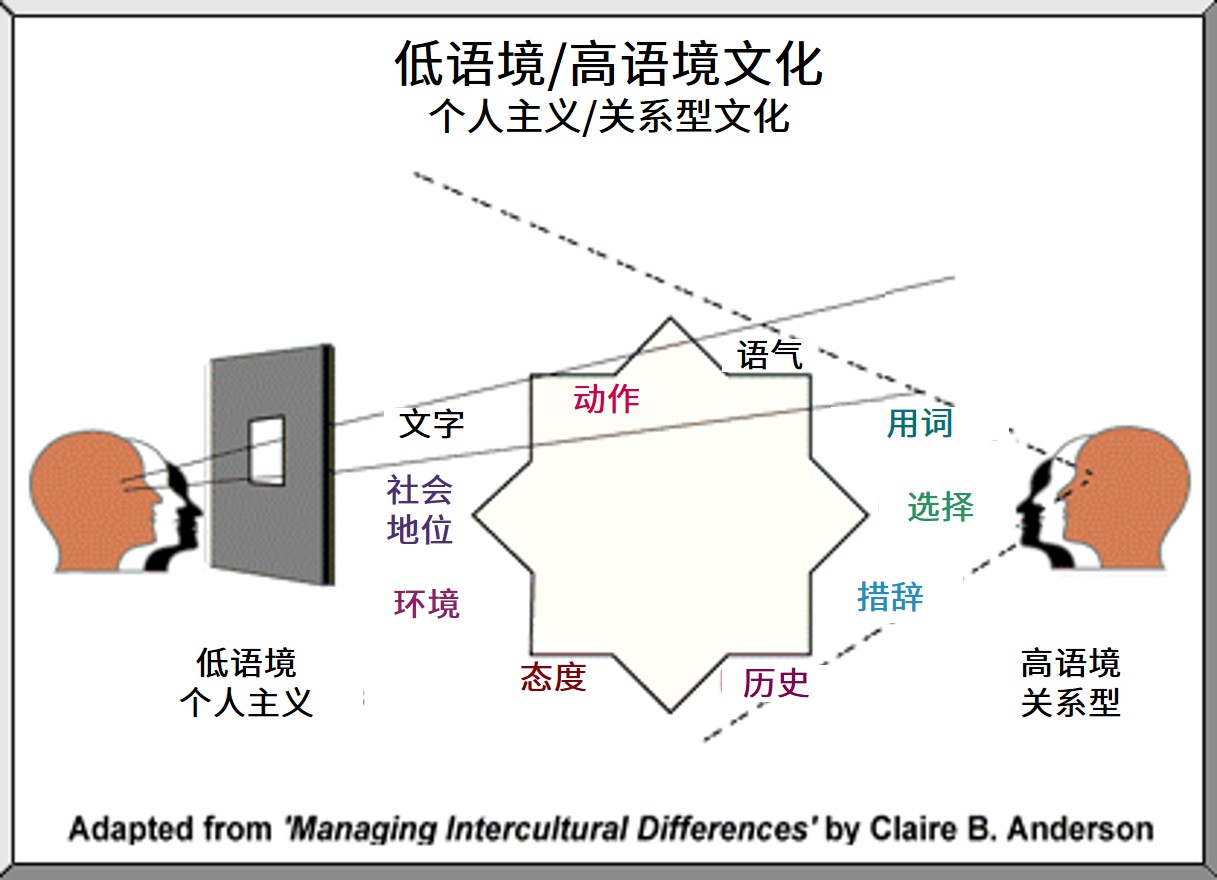
语境沟通造成的人为错误对数据可靠性的影响
2019.06.10
尽管直接负责数据可靠性的人员尽最大努力改善,但人为错误仍然无时不在。公司领导层必须始终考虑人为因素将如何影响组织的数据可靠性,因为即使是拥有最先进的数据可靠性实践的最成熟组织也可能经历人员流动或招聘新员工,这些新进人员必须接受教育并融入到组织的文化和运营之中。
人为...
|
|
质量文化日益受到监管者和企业关注
2019.05.25
前日,美国 FDA 副局长 Mark Abdoo(杨渡)先生在北京大学以质量文化为题做了报告,强调了质量、诚信和创新三个做人和制药的重要概念。【质量、诚信与创新 – FDA副局长在北大演讲】。业界对质量文化的关注日益增加,监管机构和行业专家都强调,仅靠法规和指南中规定的技术控制和说...
|

|
质量、诚信与创新 – FDA副局长在北大演讲
2019.05.24
2019年5月23日上午,美国FDA副局长Mark Abdoo杨渡先生一行与国际药物工程管理 (International Pharmaceutical Engineering Management, IPEM)和北大师生见面会在北京大学医学部举行。
自2006年支持IPEM项目创办以来,美国FDA已经派出百余人次授课,局长级别的访问交流虽然也已...
|

|
仿制药行业再陷水深火热?
2019.05.17
近期,从有关定价问题的诉讼到关于仿制药行业质量的新闻报道,再到一本披露仿制药内幕的新书,这一切对于仿制药行业来说都不是一个好消息。
上周末,刚刚出版的新书《药瓶中的谎言:仿制药兴盛的内幕故事》(“Bottle of Lies The Inside Story of the Generic Drug Boom”)的作者 K...
|