|
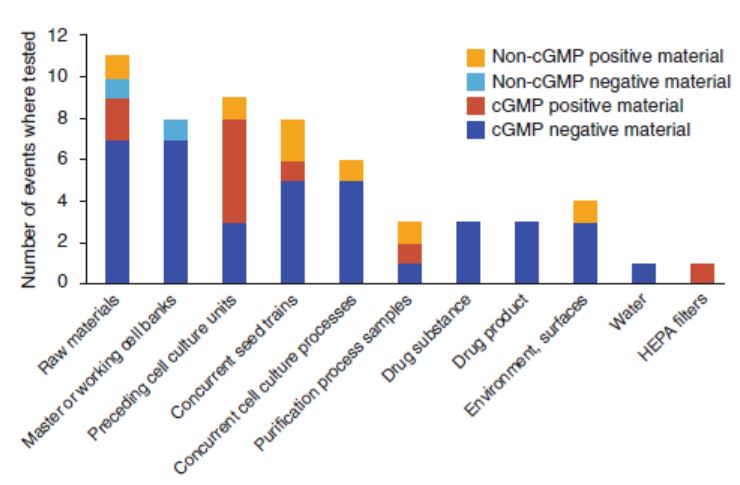
MIT 与二十多家企业合作研究生物制药中的病毒污染事...
2020.05.07
过去几十年中,曾发生十几起蛋白质药物产品线被病毒污染的事件。虽然这些事件都在药物到达患者之前就被发现,但是许多事件导致了后续昂贵的清理工作,甚至导致药品短缺。而由于这些事件并不常见而且很多并未公开报道,使得从过去的事件中学习变得很困难。
麻省理工(MIT)牵头的一个由...
|

|
印度药企呼吁 FDA 在疫情期间执行虚拟现场检查
2020.05.06
作为全球最大的药品出口国之一的印度正受到新型冠状病毒疫情的沉重打击,原因是全球旅行限制使得药厂日常运行复杂化,其中一个原因就是,FDA 对国外检查已暂停将近两个月,并且没有丝毫的恢复迹象。印度药企正在努力寻找解决方案,希望 FDA 在疫情期间对生产场地执行虚拟检查。
根据...
|
|
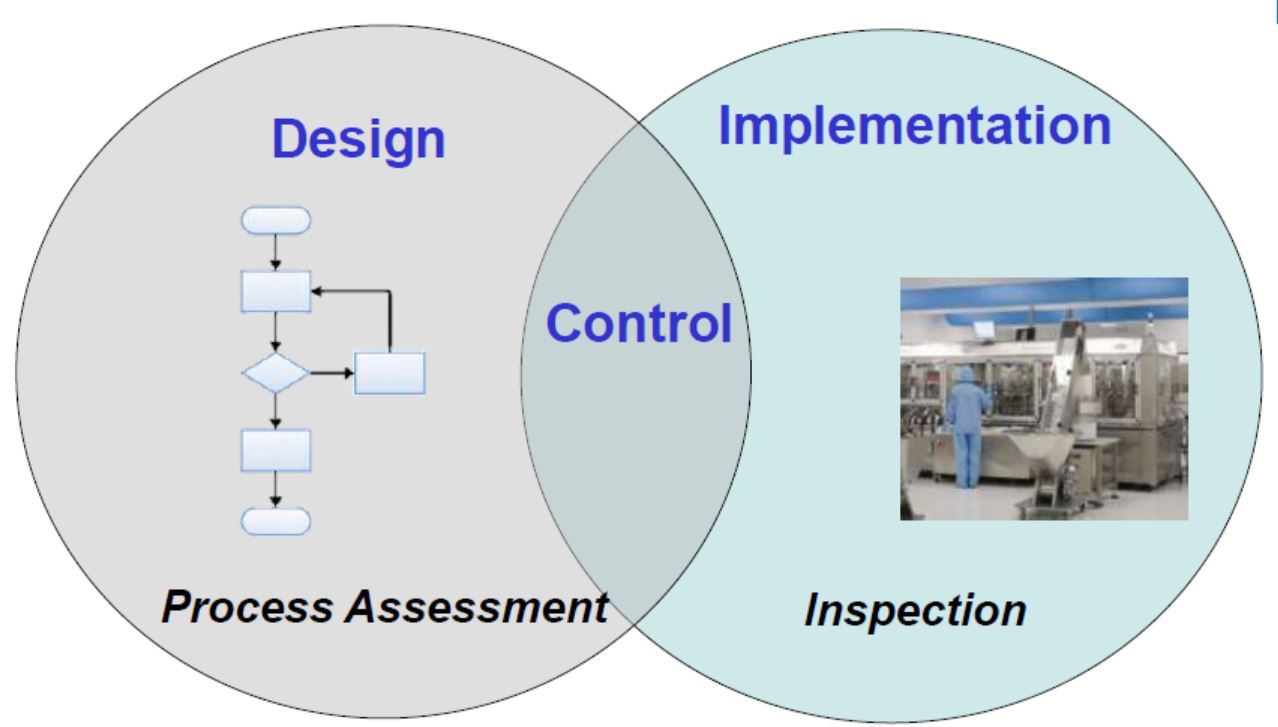
FDA 仿制药生产工艺和设施评价中的常见缺陷
2020.05.01
仿制药生产工艺和设施评价中常见缺陷有哪些?FDA 审评员提出这些缺陷背后的考虑是什么?企业回复这些缺陷应考虑哪些方面?4 月 15- 16 日,美国 FDA 一年一度的http//lib.shilinx.com/tube.php/video/view/tube_video_set_id/129仿制药论坛上,药品审评与研究中心(CDER...
|

|
【周末杂谈】足够好的质量和足够低的价格
2020.04.26
受国际形势变化的影响,中国出口欧美的医药产品,本已进入逆风时代。新冠疫情只是加快了进程,加强了风力,扩大了影响面。这不,疫情还没过,正当各地官方和民间争先恐后地向中国购买紧缺的防疫物资和医药产品的时候,“非中国造,Not Made in China”的说法,就已经开始散布。类似或...
|

|
FDA 检查冻结合规判定或加速,疫情下企业纠正措施难...
2020.04.10
新型冠状病毒疾病(COVID-19)大流行,可能会导致美国 FDA 加快对之前已检查设施的合规行动,因为检查员不再出现场,他们或有更多时间来完成对以前检查的设施评估。但,检查冻结可能会使制药商在拿到不利检查结果后试图使工厂重新达到合规状态更加困难,并且可能会延迟 FDA 对检查设...
|
|
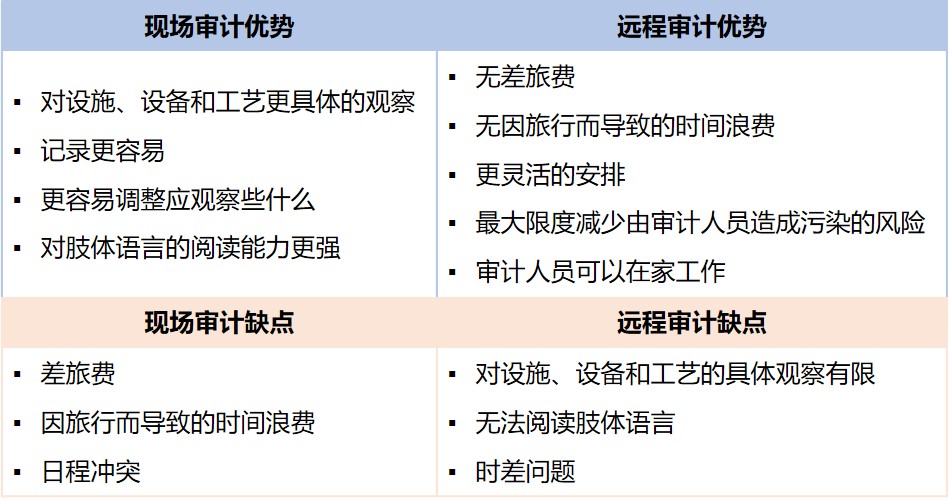
疫情下如何开展远程 GMP 合规审计
2020.04.10
新型冠状病毒疫情(COVID-19)大流行的笼罩下,每个受监管的制药企业也都不可避免地受到影响,同时也暴露了全球供应链的脆弱性以及对应急计划缺乏重视。本文重点介绍 GMP 合规的远程审计,主要关注执行远程内部和外部审计所面临的挑战、优势和最佳实践。
审计通常用于多方面的原因,...
|

|
医院和药房检测药品质量是可持续的方法吗?
2020.04.09
前段时间我们曾介绍过美国医疗机构对于公开质量评级持普遍支持态度,远比药业积极得多。但医院对于当前市场上药品的质量状态非常担心,虽然 FDA 一再保证仿制药的质量与品牌药一样。【公开质量评级,医院比药业更支持 2020/02/29】。医疗机构对处方的仿制药无效、仿制药被召回或售罄...
|

|
如何说服公司投资过程分析技术(PAT)
2020.04.04
多年来,制药业高管普遍拒绝在过程分析技术(PAT)上花钱,尽管这些技术可以减少运行时间、控制成本并确保更稳健的制造过程。最近在 IFPAC(国际过程分析与控制论坛)年会“为 PAT 打造商业案例”会议环节,辉瑞、Vertex 制药和 Biogen 公司介绍了他们在说服管理层投资过程分析技术...
|
|
FDA 关于雷尼替丁中 NDMA 杂质情况的问答更新
2020.04.03
昨日的资讯中介绍了美国 FDA 要求所有雷尼替丁制药商将产品撤市,今天我们来看看 FDA 在更新的问答文件中对于这一决定的说明。
关于雷尼替丁产品中 NDMA 杂质的重要信息
美国 FDA 已经要求制药商从市场上撤回所有雷尼替丁。这意味着雷尼替丁产品在美国将无法通过新的或现有处...
|

|
FDA 发布有关制药商停产和中断生产通知要求的指南
2020.03.31
美国 FDA 于 3 月 27 日发布了有关制药商应如何向 FDA 通报有可能导致有意义的供应中断的某些产品的永久停产或中断生产。自新冠疫情发生以来,FDA 曾表示,到目前为止,只有一家公司报告了一种人用药的短缺,但 FDA 以机密商业信息为由拒绝透露公司或药物名称。FDA 不能透露公...
|

|
FDA 2019财年警告信趋势:继续加强对供应链和非处方...
2020.03.18
昨日我们回顾了 2019 财年 FDA 的药品 GMP 警告信,概述了 2019 财年的数据以及 2013 财年以来的警告信趋势。今天我们更深入地来看看收到警告信的制药商类型,包括非处方药(OTC)制药商和顺势疗法制药商,人细胞疗法制造商,与血管紧张素 II 受体阻滞剂(ARB)的亚硝胺污染相...
|

|
FDA 2019 财年警告信趋势分析:美国境内警告信大增...
2020.03.17
美国 FDA 2019 财年发布的警告信在主题的多样性、重点以及执法行动趋势方面都值得好好分析。本文提供了 2019 财年发布的药品警告信的综合摘要,包括对 2013 财年以来的警告信趋势评估。文中 2019 财年的数据基于 FDA 于 2020 年 1 月 20 日之前公布的药品 GMP 警告信。...
|

|
FDA 将于 2021 年新建先进制造实验室促进连续制造...
2020.03.12
美国 FDA 计划于 2021 年在其总部附近建立一座制造研究实验室,以容纳一个用于模拟原料药和制剂制造过程的试验工厂,促进对新型制造技术的评估。根据 FDA 2021 年预算要求文件,其在基础设施建设上的预算要求预计增加 630 万美元,新制造实验室将帮助其推广先进制造技术,例如连续制...
|

|
美国拟建连续制造卓越中心帮助仿制药商采纳新技术
2020.03.02
罗格斯(Rutgers)大学教授 Fernando Muzzio 在国会听证会上作证时表示,虽然品牌药公司正在应用连续制造,但其他公司(包括仿制药和非处方药公司)却在为实施连续制造所需的成本和知识而苦苦挣扎。
1 月 29 日,Muzzio 在众议院能源与商贸委员会卫生分委会举行的关于一系列涉及...
|

|
公开质量评级,医院比药业更支持
2020.02.29
美国 FDA 与医疗机构最近在华盛顿举行的杜克大学 Margolis 卫生政策中心研讨会上达成一致,认为公开药品质量评级将使患者和消费者受益,但 FDA 与医疗机构之间对于当前的质量状态有着巨大分歧。
FDA 集中精力于如何确保公众能够接受品牌药和仿制药的质量,而医疗机构则担心 FDA...
|
|
新型冠状病毒疫情可能引发的潜在药品短缺
2020.02.28
美国FDA 正在加强对药品供应链的潜在短缺监测,其中包括 20 种可能因新型冠状病毒疫情而处于短缺风险之中的产品(目前尚未报告短缺)。仿制药商预测,新型冠状病毒疫情引发的短缺最早可能会在6月或7月显现。在谈论疫情造成的供应链问题的同时,美国舆论对于药品供应链的脆弱性以及对于...
|

|
FDA 公布发给粗品肝素生产商、仿制药商和非处方药商...
2020.02.27
美国 FDA 于 2 月 25 日公布了发给四家制药企业的警告信,其中包括粗品肝素生产商宜宾利豪,印度非处方产品生产商 JHS Svendgaard 以及合同制造商 Essnd Global 公司,美国的仿制药商 KVK-Tech公司。我们将在本文中概述这些警告信中的重点问题,详细内容请登录识林阅览。
...
|

|
欧盟无菌GMP指南第二轮征求意见稿发布
2020.02.22
2020年2月20日,欧盟发布了无菌GMP附录(Annex 1)的第二轮征求意见稿,这是2017年12月20日发布的征求意见稿时隔两年多的再次更新。WHO和PIC/S也同步征求意见,最终实施后会对全球无菌制剂企业产生重大影响。
不是修订,而是重写
欧盟无菌附录 1971年首次颁布,期间经过多次修订...
|

|
从近期警告信缺陷项再看原料药鉴别检验
2020.02.19
鉴别检验(identity testing)想必大家并不陌生,根据对 FDA 2020 年 1 月发布的警告信回顾显示,有三篇警告信指证了在制剂生产之前未能对原料药成分执行鉴别检验。现在我们再来看看与鉴别检验有关的缺陷项以及相关的 FDA 指南。
下面先来看看一月份这三篇警告信中涉及鉴别检验的内...
|

|
FDA与印度政府采取行动保护消费者免受非法医疗产品的...
2020.02.18
FDA Takes Action with Indian Government to Protect Consumers From Illicit Medical Products
The U.S. Food and Drug Administration today announced that its first bilateral enforcement operation with the Government of India, stopped approximately 500 s...
|