
|
欧洲药品管理局总部将迁至荷兰阿姆斯特丹
2017.11.21
经过数月激烈的政治争斗,欧洲委员会于 11 月 20 日投票决定将欧洲药品管理局(EMA)总部从英国伦敦迁至荷兰阿姆斯特丹。
旗鼓相当的投票结果意味着 EMA 选择阿姆斯特丹可能会比选择亚军米兰遇到稍少的干扰。最近一项对 EMA 工作人员的问卷调查青睐于阿姆斯特丹优秀的国际航班...
|

|
监管机构对新药元素杂质风险评估的评价褒贬参半
2017.11.20
ICH Q3D 元素杂质指南于 2016 年 6 月对新药生效,但到目前为止似乎还没有完全解决对药品中存在元素杂质的担忧。来自欧洲药品管理局(EMA)和加拿大卫生部的监管者对于为符合 ICH Q3D 指南而在新药申请中提交的元素杂质风险评估质量给出了不同的评价。
在 11 月 2 日由药品质...
|

|
基于健康的暴露限度是否应作为清洁验证可接受值的基础
2017.11.19
是否应该修订目前行业普遍使用的清洁验证限度(药品最小治疗剂量的 1/1000 或 10 ppm)以支持基于健康的暴露限度(Health Based Exposure Limit,HBEL),对这一问题的回答是 2017 年 6 月 20 – 21 日在欧洲药品管理局(EMA)举行的“基于健康的暴露限度的产生和使用研讨...
|
|
FDA 宣布综合性再生医学政策框架
2017.11.18
(翻译自 FDA 新闻稿 https//www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm585345.htm?utm_campaign=11162017_PR_FDA%20announces%20Regen%20Med%20Framework&utm_medium=email&utm_source=Eloqua "FDA announces comprehensive regenerative medicine poli...
|

|
直言简语将成为 FDA 指南的风格
2017.11.16
美国 FDA 正在接受使用简短的要点式的指南来交流其对未来药品研发的思考。而不是继续发布充斥着法律、长篇大论,有时还有大量脚注的指南,未来这些文件将缩短到几页,仅包含 FDA 想要讲清楚的要点。
FDA 药品审评与研究中心(CDER)主任 Janet Woodcock 于 11 月 14 日表示...
|

|
FDA 拟改变遗传健康风险测试的上市前通知路径
2017.11.15
美国 FDA 于 11 月 8 日发布了有关直接面向消费者(DTC)的基因测试的两份最终命令和一份通告,这可能对此类测试的开发者产生重大影响。命令之一将 FDA 关于 23andMe 公司的遗传健康风险(GHR)评估系统的 de novo 授权编入法典(GHR 命令)。https//www.federalregister.gov/docum...
|

|
FDA首批嵌有电子传感器跟踪用药依从性的药片
2017.11.14
(翻译自 FDA 新闻稿 https//www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm584933.htm?utm_campaign=11132017_PR_FDA%20approves%20sensor%20pill%20for%20Abilify&utm_medium=email&utm_source=Eloqua "FDA approves pill with sensor that digitally tracks if...
|

|
制药商应生成自己的元素杂质数据以符合 ICH Q3D
2017.11.13
11 月 2-3 日由药品质量研究学会(PQRI)和美国药典(USP)主办的 ICH Q3D 的实施会议上,专家表示,根据国际协调理事会(ICH)Q3D 元素杂质指南,制药商不应该依赖从辅料或原料药供应商那里获得的信息来完成所要求的风险评估。相反,他们应该依靠自己的内部检测计划或公开文献。...
|

|
FDA 将准备好在首仿专营权到期后上市的仿制药申请列...
2017.11.10
为加速竞争和降低药价,美国 FDA 将对那些可能准备好在首仿药专营权到期或到期后不久批准的仿制药申请采取优先审评;专家表示,此举将曾经非正式的仿制药办公室(OGD)政策正式化了。
对准备好获得批准的产品类别的扩展包含在 11 月 9 日发布的《MaPP 5240.3 原始 ANDA、增补...
|

|
FDA 采取基础步骤改善仿制药企业对品牌药样品的获取
2017.11.09
美国 FDA 局长 Scott Gottlieb 一直在关注 FDA 为遏制品牌公司滥用风险评估与减轻策略(REMS)系统阻挠仿制药进入所做出的努力。FDA 于 11 月 8 日的https//www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm584259.htm 声明宣布 FDA 发布《对共享系统 REMS...
|

|
美国仿制药秋季技术会议上关于优先审评剖析的简报
2017.11.08
11 月 8 日 美国普享药协会(AAM)秋季技术会议的第三天,Lachman 咨询公司高级顾问 Bob Pollock 与专家小组成员 Teva 制药北美仿制药法规事务副总裁和 Hyman,Phelps & McNamara 律所主任 Kurt Karst 一道主持了“优先与加快审评剖析”小组会议。下面是 Pollock 先生...
|

|
美国仿制药秋季技术会议速递 - I
2017.11.07
美国普享药协会(AAM,原仿制药协会)秋季技术会议于 11 月 6 日召开,美国 FDA 仿制药办公室(OGD)主任 Kathleen (Cook) Uhl 在会议上报告了 OGD 的现状,并没有太多新信息,大多数统计数据都在我们之前的资讯【GDUFA I 行动报告:FDA 和业界 5 年的行动成果 2017/11...
|

|
FDA 局长推动产品审评的团队工作
2017.11.06
美国 FDA 局长 Scott Gottlieb 打算将来自多个学科的药品审评人员重组为可掌控产品整个生命周期的团队,企图打破久为人知的 FDA 内许多领域的孤立性。
Gottlieb 于 11 月 3 日在美国国家记者俱乐部的演讲上表示,处理上市前审评的 FDA 专家也应在上市后监测中继续参与。...
|

|
FDA 修订关于仿制药优先申请的申报前设施通信指南
2017.11.05
美国 FDA 于 11 月 3 日发布了确保 ANDA 获得优先审评所需的《ANDA:与仿制药优先申请有关的申报前设施通信》指南草案修订版本。
作为仿制药使用者付费修正案(GDUFA II)谈判的一部分,FDA 同意将符合优先资格的仿制药的审评时间从 10 个月缩短到 8 个月,但申办人必须在 ...
|

|
GDUFA I 行动报告:FDA 和业界 5 年的行动成果
2017.11.03
在 2012 年 GDUFA 生效后,根据法案承诺的透明方案,FDA 将在网站张贴行动报告,这个公告栏网页包括一系列有关申请提交和处理的行动,公告栏每月更新一次。虽然FDA的更新步伐总是滞后 2-3 个月,我们还是在新财年过去一个月后,看到了 GDUFA I 项目最后一个月的行动报告,这也标志着 ...
|

|
FDA 在医疗器械网络安全方面的作用
2017.11.02
(译自FDA Voice https//blogs.fda.gov/fdavoice/index.php/2017/10/fdas-role-in-medical-device-cybersecurity/ “FDA's Role in Medical Device Cybersecurity” 2017 年 10 月 31 日,作者:Suzanne B. Schwartz, M.D., M.B.A.,FDA 医疗...
|

|
FDA 发布指南解释 GDUFA II 仿制药付费相关内容
2017.10.31
10 月 27 日,美国 FDA 发布指南草案《依据 2017 仿制药使用者付费修正案评估使用者费》为企业提供了 GDUFA II 下使用者付费的评估指导。关于费用支付有一些隐藏的雷区,尤其是关于项目费和有关撤销 ANDA 请求的提醒信息,以及其对项目费层级认定的影响,包括必须支付新项目费...
|

|
IPEM 11 月课程预告 - 研发与产业化方向
2017.10.29
Integrity
授课老师:Peter Baker
上课日期:11 月 9 日上午
授课方式:中英文交传
上课地点:北大中关新园
老师简介
Peter Baker 先生现任美国 FDA 国际项目办公室(OIP)下设的中国办公室负责药品检查的代理副主任。自 2008 年以来,作为 FDA 检查官在全球...
|
|
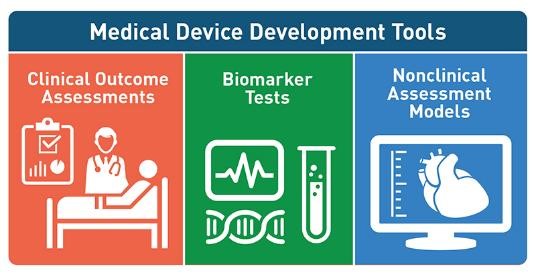
FDA 医疗器械研发工具:帮助加快医疗器械评估与批准
2017.10.26
(译自FDA Voice https//blogs.fda.gov/fdavoice/index.php/2017/10/medical-device-development-tools-helping-to-speed-medical-device-evaluation-and-approval/ “Medical Device Development Tools Helping to Speed Medical Device Evaluation and Approval” ...
|

|
FDA 关于生物类似药的宣传活动未对非医疗替换表态
2017.10.25
美国 FDA 的新生物类似药宣传活动并不能解决非医疗替换(non-medical switching)争议,但是试图消除对生物类似药和可互换生物制品之间差异的担忧。
这项针对医疗保健提供者的宣传努力是一次回答有关生物类似药和可互换生物制品的尝试,包括批准标准和研发要求。FDA 局长 Scott Gottl...
|