
|
FDA修订仿制药申请审评质量管理规范手册MAPP 5241.3
2023.10.18
美国 FDA 于 10 月 6 日发布了 MAPP 5241.3 《ANDA 评估质量管理规范》的更新版本Rev.1。此次升版主要反映了GDUFA III 中的变化,并未对 ANDA 批准的监管要求进行任何本质上的更新。
MAPP 初始版本于 2018 年 1 月发布,识林将前后两版本对比,总体变化不大,对比...
|

|
FDA首次修订仿制药申请立卷审查手册MAPP 5200.14
2023.10.17
美国 FDA 药品审评与研究中心(CDER)的《政策和程序手册》(MAPPs)是联邦指令以及内部政策和程序文件。MAPP 是法律规定的,并向公众提供,使得CDER 成为一个更加透明的组织。
本次修订的是 MAPP 5200.14 Filing Review of Abbreviated New Drug Applications,即,ANDA 申...
|

|
ANDA 合并与所有权转移均可能影响下一年仿制药缴费
2020.08.28
美国 FDA 仿制药办公室(OGD)于 8 月 26 日发布政策和程序手册《MAPP 5242.1 所有权转移》,介绍了 OGD 的橙皮书工作人员将如何处理由药品申请的前所有者和现所有者提交的转移申请所有权。
橙皮书是 FDA 发布的提供已批准的所有处方药的清单,包括对多家来源药品的治疗等...
|
|
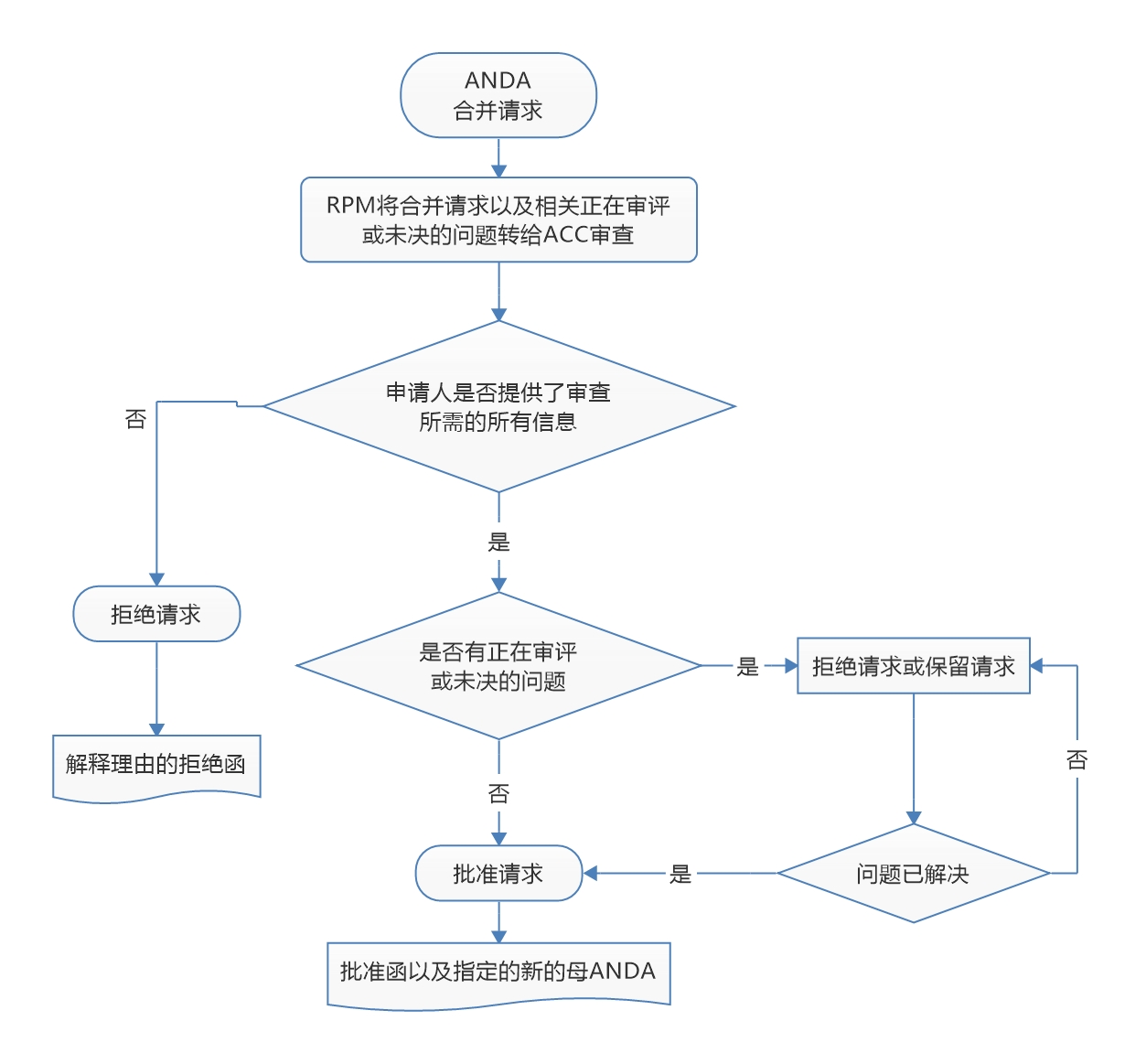
FDA 发布同一产品不同规格 ANDA 号合并的修订程序...
2020.08.21
美国 FDA 仿制药办公室(OGD)于 8 月 19 日发布了修订政策与程序手册(MAPP 5241.2 Rev.1)《仿制药办公室的ANDA合并》,介绍了相同厂家、同一药品、不同规格的多个 ANDA 申请号合并为一个 ANDA 申请号的政策和程序。
该手册的最初版本于 2015 年 10 月发布,此次发...
|

|
FDA 收紧仿制药审评优先政策
2020.02.03
美国 FDA 于 1 月 31 日发布了对政策和程序手册(MAPP)5240.3《原始 ANDA、增补和补充申请的审评优先级》的第五次修订版本,解释了 FDA 对于某些仿制药优先审评的新限制。FDA 表示,此举旨在将有限的 FDA 资源有效地分配给那些通过优先审评最有可能显著增加仿制药可及性并确...
|

|
FDA 发布内部指南解释检查场地选择模型
2018.09.07
美国 FDA 药品质量办公室(OPQ)于 9 月 5 日发布新的内部指南,解释了 FDA 工作人员必须使用的确定 GMP 监督检查优先顺序的风险因素。通过发布有关这一基于风险模型的信息,FDA 旨在提供一些其决策过程的透明度。
2012《FDA 安全与创新法案》(FDASIA)修订了《联邦食品、...
|

|
FDA 仿制药申请评估新体系
2018.01.04
我们在昨天的资讯中介绍了美国 FDA 发布了两份文件促进仿制药的高效审批,这两份文件分别是《ANDA 提交质量管理规范》(Good ANDA Submission Practices)行业指南草案和《ANDA 评估质量管理规范》(Good ANDA Assessment Practices)政策程序手册(MAPP)。今天我们来仔细看看...
|

|
FDA 关于促进仿制药高效审批的新举措
2018.01.03
FDA Statement
2018 年 1 月 3 日
FDA 局长 Scott Gottlieb 医学博士
原文请见:https//www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm591184.htm Statement from FDA Commissioner Scott Gottlieb, M.D. on new steps to facilitate efficient generic ...
|

|
FDA 将准备好在首仿专营权到期后上市的仿制药申请列...
2017.11.10
为加速竞争和降低药价,美国 FDA 将对那些可能准备好在首仿药专营权到期或到期后不久批准的仿制药申请采取优先审评;专家表示,此举将曾经非正式的仿制药办公室(OGD)政策正式化了。
对准备好获得批准的产品类别的扩展包含在 11 月 9 日发布的《MaPP 5240.3 原始 ANDA、增补...
|

|
FDA 关闭企业授权代表以外人员对于 ANDA 审评状态...
2017.10.09
美国 FDA 仿制药办公室(OGD)长期以来一直主张,来自企业不同代表对于同一申请向不同 OGD 审评人员或高级职员的问询,只会浪费 OGD 的时间。确实是这样,但是过去的多次问询往往是因为信息难以获得,如果不是不可能获得的话,并且经常是不准确的或过时的。OGD 发布了许多指南和方...
|
|
FDA 将更多仿制药列入优先审评并提供缺少竞争的仿制...
2017.06.28
6 月 27 日,美国 FDA 颁布两项重要举措增加仿制药竞争,帮助低价仿制药进入市场:一是发布无已获批仿制药的专利到期、专营期到期品牌药清单,二是再次修订 ANDA 审评优先级程序政策手册。
这些行动是 FDA 局长 Scott Gottlieb 于今年五月末宣布的“药品竞争行动计划”中首先采取...
|

|
FDA更新具有临床终点BE研究审评的程序政策手册
2017.06.25
美国 FDA 仿制药办公室(OGD)于 6 月 22 日发布了一份修订版程序政策手册《MaPP 5210.4 修订 2:ANDA 中具有临床终点的 BE 研究审评》,更新了新的组织架构,并明确了对于具有临床终点的 BE 研究审评将在 CDER 和 FDA 组织架构中的哪部分执行。这份 MaPP 澄清了一件...
|

|
从FDA良好审评实践政策和程序手册想到
2017.02.28
美国FDA于2月27日公布了其题为《良好审评实践(GRP)》政策和程序手册(MaPP)的再认证。该文件的首个版本于2006年发布。这是该文件的第二次再认证。在回顾这份文件时,我想起了最近与行业同事就ANDA审评过程中缺乏一致性的几次电话和讨论。
虽然我认为审评过程已经随着时间的推移有所...
|

|
FDA发布ANDA审评优先级MaPP修订稿
2016.03.12
3月11日FDA发布《MaPP5240.3 原始ANDA、增补和补充审评的优先级》修订稿。MaPP(政策和流程手册)是FDA的内部政策和程序,指导FDA内部工作。这篇MaPP的主要内容是简单易懂的,但有几个问题可能需要进一步澄清。
新修订的MaPP概述了加速审评过程的历史,但没有回溯到非常早的仿制药办公...
|

|
FDA发布合并ANDA申请号的指导性文件
2015.10.28
10月26日,FDA的仿制药办公室(OGD)发布了一份政策和程序手册(MAPP)文件,题目为《仿制药办公室的ANDA合并》(Consolidation of ANDAs by the Office of Generic Drugs)。本MAPP描述的不是新事情,但是新确定了相同厂家、不同规格、同一药品的多个ANDA申请号合并为一个ANDA申...
|

|
FDA与仿制药企业交流 – 另一种声音
2015.08.23
【编者按】 FDA仿制药办公室(OGD)18日发布的政策和程序手册MaPP5200.3修订版《关于GDUFA第三年之前的简化新药申请与行业的交流》。三天前我们发表资讯,以积极乐观的态度点评了这份文件。今天,我们再来听听来自于业界的另一方观点。 希望能带给大家各方观点,帮助读者明辨式思考。
2...
|

|
FDA将在与仿制药企业交流与透明度方面大为改进
2015.08.20
FDA仿制药办公室(OGD)18日发布政策和程序手册MaPP5200.3修订版《关于GDUFA第三年之前的简化新药申请与行业的交流》。此前,2013年9月24日发布的MaPP5200.3原始版本《关于仿制药办公室ANDA行业问询的回复》中,为努力节约资源并将这些资源投入到申请审评中,OGD已基本上切断了关于ANDA...
|

|
与ANDA审评和优先级相关的两份MaPP
2014.08.04
FDA今日发布了两份新的MaPP:5200.4原始ANDA、增补和补充的审评管理标准和程序,5240.3 原始ANDA、增补和补充审评的优先级(2006年旧版题为“原始ANDA、增补和补充的审评顺序”MaPP的修订版本)。这两份MaPP描述了仿制药办公室将如何优先审评ANDA。在过去的文章中,我们曾讨论过对GDUFA...
|

|
FDA发布新MAPP 5200.3
2013.09.26
----
概述
9月24日,FDA发布新的政策和流程手册(MAPP) - MAPP5200.3“关于仿制药办公室(OGD)ANDA行业问询的回复”。该MAPP的目的是“阐明OGD的监管科项目管理(RPM)职员处理ANDA申请人授权代表(授权的询问人)对ANDA问询的一般原则”。该MAPP具体与2012仿制药使用者付费修...
|