
|
欧盟拟加强原料药安全性监督,重点关注中国和印度
2019.12.26
上周我们刚刚在【无菌药品检查国际合作试点启动,中国和印度或将面临更严检查】中预测了检查国际合作可能会让参与国家将更多检查资源集中在中国和印度,现在欧盟的另一份文件就挑明了这一问题。欧盟委员会认为最近涉及到从中国和印度进口的原料药(API)污染问题(缬沙坦和雷尼替丁中的亚...
|
|
药品供应链安全法案最后要求生效仅剩三年,业界前路仍...
2019.12.25
美国《药品供应链安全法案》(DSCSA)于 2013 年 11 月 27 日签署成为法律,要求在十年内分阶段走最终建成可以识别并追踪在美国分销的处方药的电子化、可互操作系统,现在已经过去七年的时间,距离法案的最终要求还有多少距离呢?
DSCSA 修订了《联邦食品、药品和化妆品法案》,...
|

|
欧洲药品管理局着手机构改革,应对新挑战
2019.12.24
欧洲药品管理局(EMA)将着手开展涉及机构改革的“面向未来”的行动,以使其能够更有效地应对“人员的永久减少”以及在科学、技术和立法方面的新挑战。
EMA 管理委员会 12 月会议上提出的新架构包括成立四个新的工作组,以聚集在“高影响力领域”的专家,例如数字化转型、监管科学与...
|
|
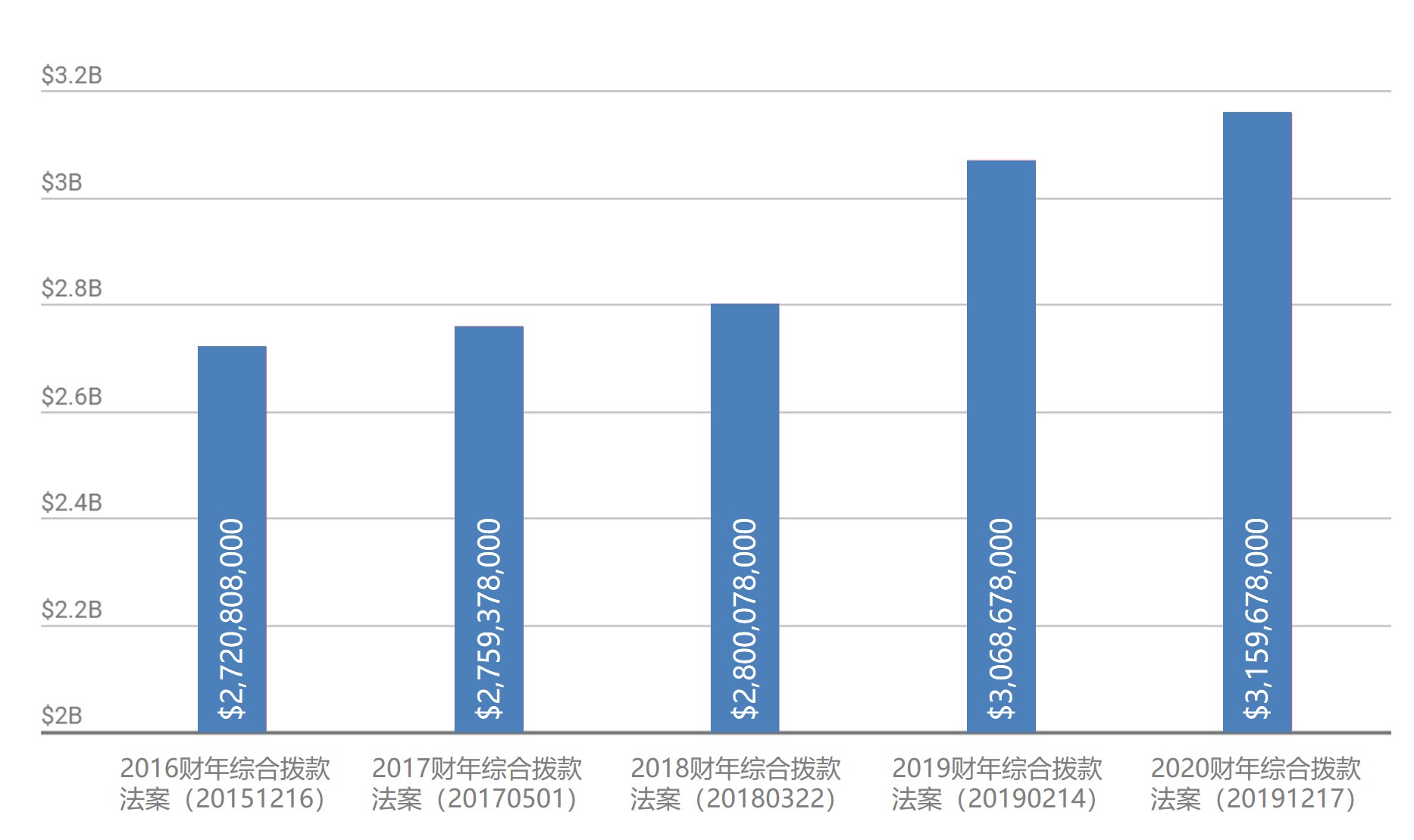
FDA 2020财年拨款仿制药现代化项目资金被削减
2019.12.20
美国 FDA 在 11 月 17 日众议院通过的 2020 财年拨款计划中获得了总额 58 亿美元的资金,比 2019 财年(56.7 亿)增加近 4%(18750 万),其中非使用者费资金(预算授权)为31.60 亿美元,比 2019 财年(30.68 亿)增加近 3%(9100 万美元)。拨款法案预计将很快在...
|

|
FDA为提高外包设施中配药质量成立卓越配药质量中心
2019.12.19
FDA takes efforts to improve quality of compounded drugs from outsourcing facilities through collaboration and education as part of new Center of Excellence
Compounded drugs can serve an important role in meeting patients’ medical needs that cannot ...
|
|
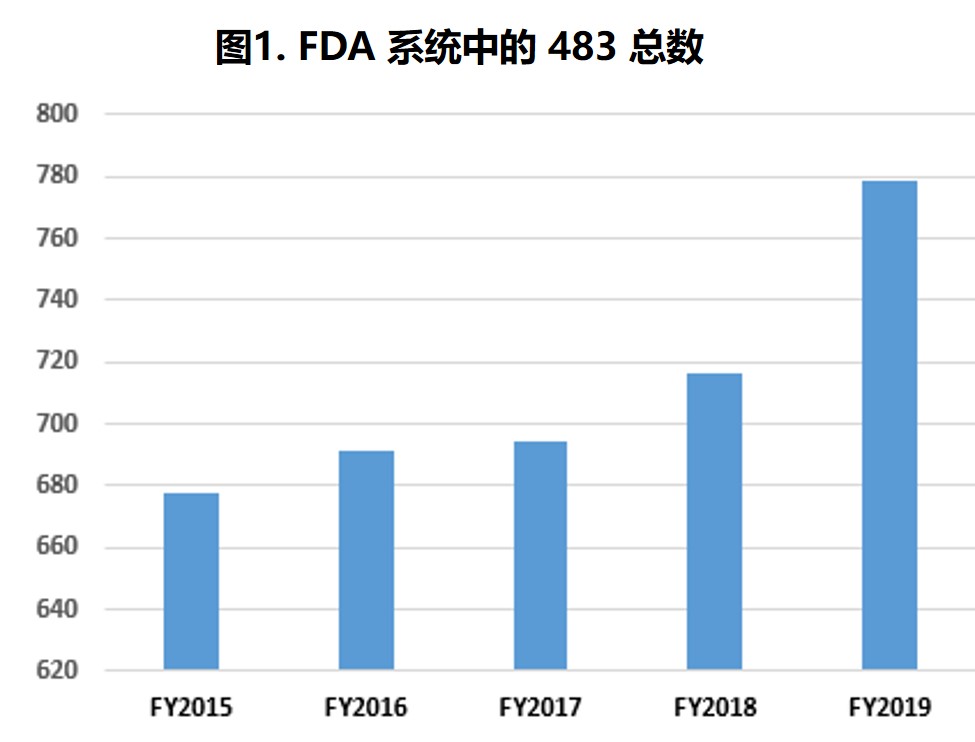
FDA 2019 财年药品检查观察项和趋势
2019.12.19
过去五个财年中,分析中所包含的 483 数量每年都略有增加,检查次数在 645 到 779 次之间(表1第2行和图1)。
自 2013 财年以来,指证 §211.192(偏差调查)失败的观察项在 2018 财年首次从名单魁首的位置上移下来。
2018 财年,§211.160(b)(实验室控制应包括科学合...
|
|
美国大学开设先进冻干实验室助力生物制造研发
2019.12.18
美国麻萨诸塞州大学洛厄尔分校开设了一间先进的冻干实验室,帮助推动新英格兰及其他地区生物药制造的创新和发现。
新实验室被称为冻干研究湾(Lyophilization Research Bay)或 LyoBay,是美国东海岸第一个试点规模的设施,位于洁净间环境中,可供外部用户使用。LyoBay 有望为更高...
|

|
质量量度升级版呼之欲出?
2019.12.17
12月5日在FDA总部边上举办的ISPE全球制药监管峰会上,质量量度再次成为业界关注的议题。FDA向业界表示质量量度项目是FDA当前高优先级的项目,FDA正在着力推出整合了过去几年FDA、工业界和学术界研究和试点经验教训的改造版质量量度。
自FDA于2015年7月发布质量量度指南草案以来已经过去...
|

|
FDA 关于低价生物类似药和可互换蛋白质产品的声明
2019.12.17
Statement on low-cost biosimilar and interchangeable protein products
For Immediate Release
Statement From
December 17, 2019
Deputy Commissioner for Policy, Legislation, and International Affairs - Food and Drug Administration
Anna Abram
Direct...
|

|
FDA 新研究证明有六个竞争者的仿制药价格降幅超九成
2019.12.16
根据一项使用两种不同批发价格来源的 FDA 最新研究分析发现,仿制药商之间更多的竞争与更低的仿制药价格相关。FDA 的研究再次给出了强有力的证据:最初仿制药进入市场后,随着更多竞争的出现,仿制药价格下降,并且近年来仿制药价格相较十五年前下降幅度更大。
这项新研究建立在 FD...
|

|
FDA 新分析突出仿制药商之间更多的竞争与更低的仿制...
2019.12.13
New analysis highlights link between generic drug competition and lower drug prices, underscores importance of FDA efforts to spur generic drug development and market entry
新的分析突出了仿制药竞争与更低的药品价格之间的联系,强调了FDA努力...
|

|
参议院确认Stephen Hahn为新任FDA局长
2019.12.13
美国参议院于 12月 12 日全院表决 72-18 票确认休斯顿 MD 安德森癌症中心首席医疗行政官 Stephen Hahn 医学博士为美国 FDA 下一任局长。
Hahn 现年 59 岁,是一名研究人员、医学和放射肿瘤学家,负责癌症中心的临床护理,之前在华盛顿并没有政治经验。他是自 Scott Go...
|
|
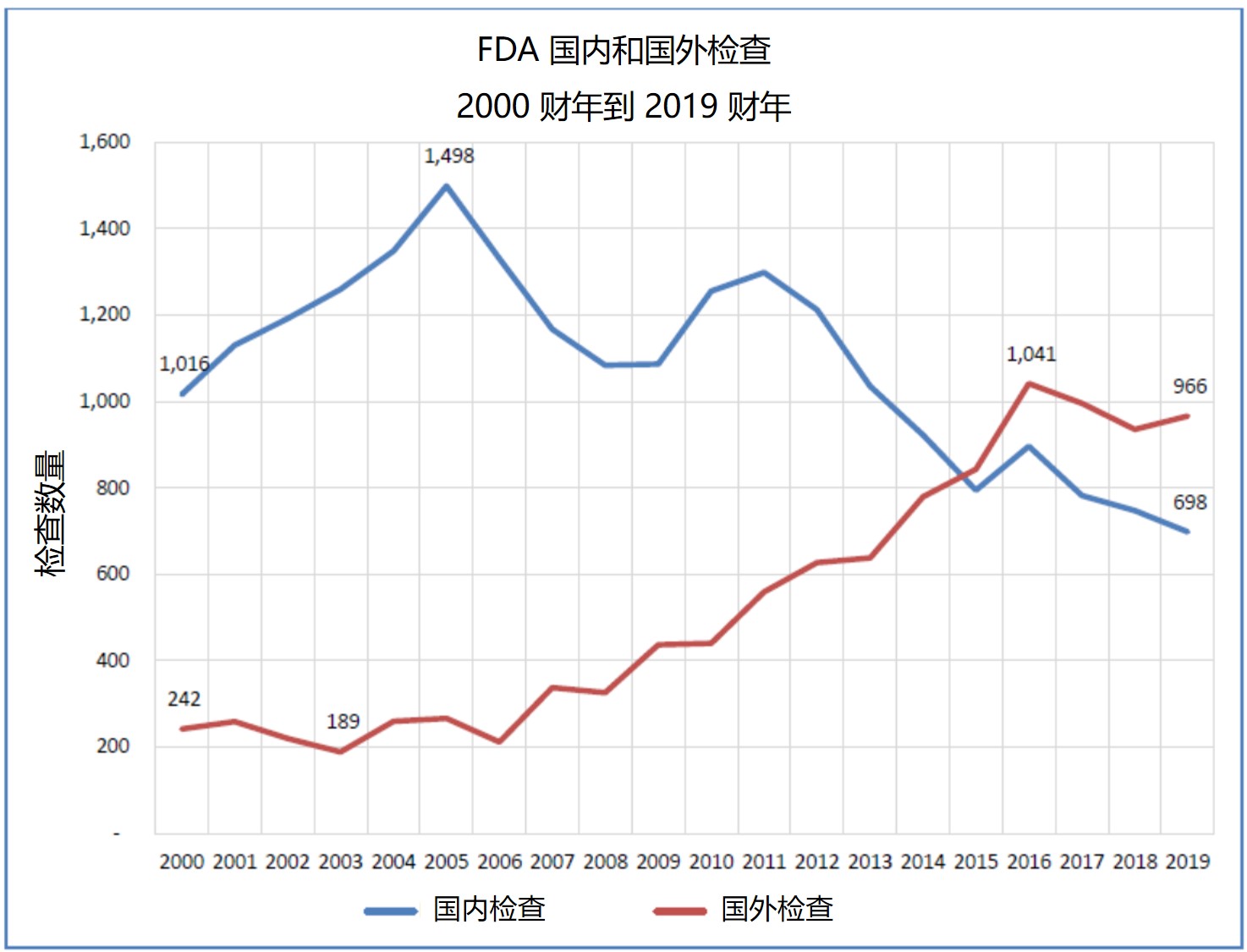
FDA 药品中心主任表示国外检查需要更多检查员和翻译...
2019.12.12
美国 FDA 药品审评与研究中心(CDER)主任在 12 月 10 日举行的众议院能源与商业监督小组委员会关于“保护美国药品供应链:监督 FDA 国外检查计划”听证会上表示,如果国会批准,FDA 可以使用更多资源执行更多国外检查。听证会上,Woodcock还为有关 FDA 严重依赖国外提前通知的...
|

|
两家美国公司因 GMP 违规收到 FDA 警告信
2019.12.12
美国 FDA 于 12 月 10 日因 GMP 违规向两家美国制药商发出警告信,这两家公司分别为位于新泽西州 Buena 市的 Teligent 药业和位于德克萨斯州 Mineral Wells 市的 OHM 药业公司。警告信原文及翻译请登录识林阅览。
Teligent Pharma
FDA 于今年 4 月到 5 月期间对 T...
|

|
FDA与MHRA领导人在ISPE全球监管峰会上关于制药创新的...
2019.12.11
国际制药工程学会(ISPE)全球制药监管峰会于 12 月 5–6 日在美国马里兰州 Bethesda 举行。今年会议的主题是“在生命周期管理中激发研发和质量方面的创新”。美国 FDA 药品审评与研究中心(CDER)主任 Janet Woodcock 和英国药品和卫生产品监管机构(MHRA)检查策略和创新部门副主管 ...
|
|
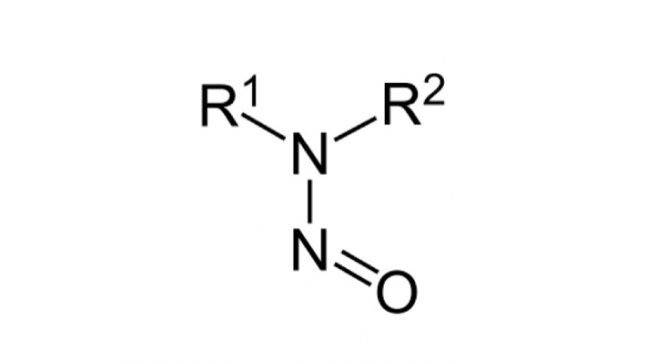
欧洲药用辅料协会制定亚硝胺风险评估问卷
2019.12.05
Questionnaire for Excipient Nitrosamines Risk Evaluation
IPEC Europe developed a questionnaire in consultation with other pharmaceutical-related associations (including EFPIA) to facilitate gathering information on pharmaceutical excipients for drug pr...
|

|
ICH Q12 指南定稿,更多新指南雏形初现
2019.12.04
ICH 在其最近于 11 月 16 日至 20 日举行的新加坡会议上定稿了三篇关键指南,其中包括备受争议的批准后变更生命周期管理指南 Q12,同时还敲定了一些新指南主题的概念文件和运行计划。识林在新加坡会议之前对 ICH 一些指南的进展做了简要报道,详见:【ICH 2019-2020 年指南制定进展...
|
|
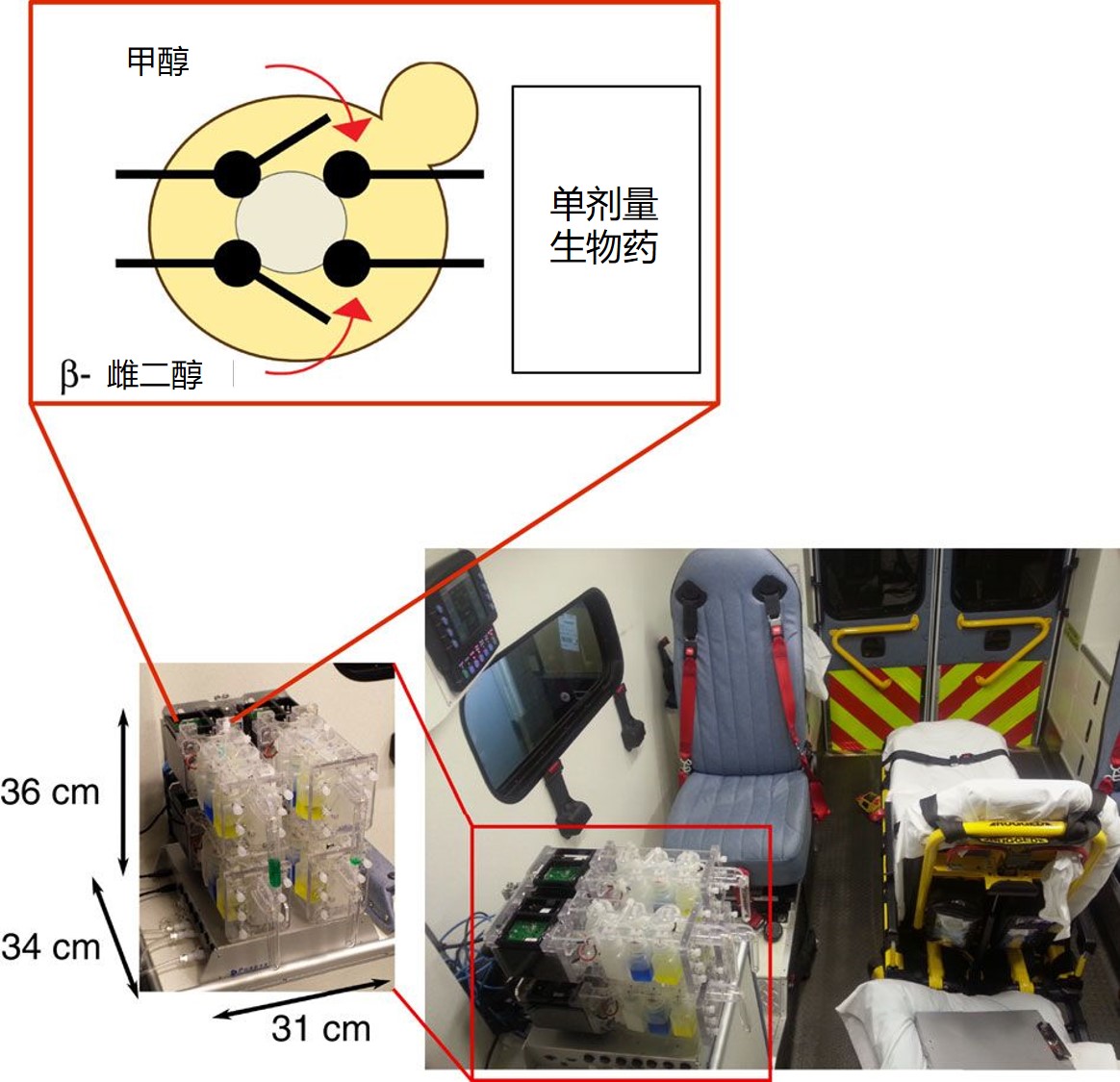
FDA 谈微型移动制造平台在未来药品供应方面的作用
2019.12.03
美国 FDA 正在考虑开发小型、按需生产的制造系统来作为解决持续存在的药品短缺的潜在长期解决方案。
美国国防高级研究计划局(DARPA)近年来已经率先开发了微型移动制造平台,该平台可支持在战场附近或在偏远驻扎地区生产基本药物。麻省理工学院(MIT)研究人员在 DARPA 的资助下已经在...
|
|
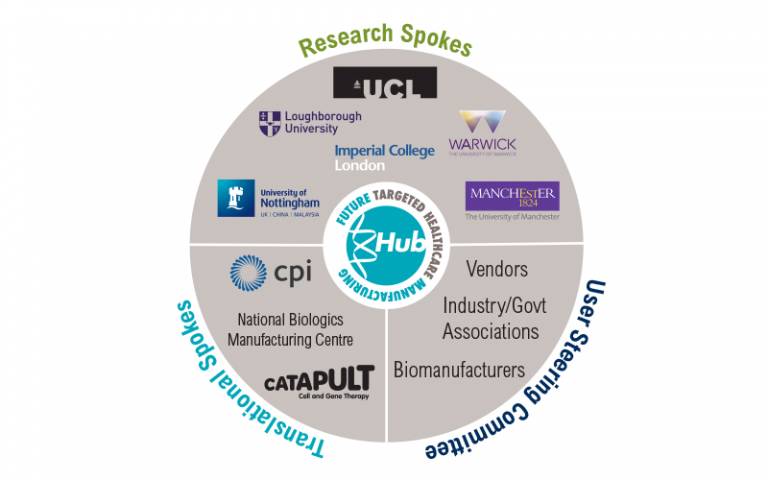
伦敦大学学院靶向医疗制造中心展望生物制造的未来
2019.12.03
伦敦大学学院(UCL)细胞和基因疗法生物过程高级讲师兼副教授 Qasim Rafiq 博士在谈到细胞和基因疗法的未来时表示,比起机器人移液,制药商更需要数据分析和自动化决策。他表示,“人们陷入到机器人的漩涡中,但是当我与合同开发和制造组织(CDMO)交谈时发现,对自动化流程控制和分析...
|

|
PICS 发布评估与变更管理相关的质量体系有效性的建议
2019.11.30
国际认证合作组织(PIC/S)于 11 月 29 日发布《关于如何评估/证明药品质量体系在基于风险的变更管理方面的有效性建议》,为 GMP 检查员在评估企业与基于风险的变更管理相关的药品质量体系(PQS)的有效性时提供了实用指导。建议涵盖了变更管理过程中的所有相关步骤:变更提议,变...
|