
|
WHO 药用辅料GMP附件1:生产和控制风险管理
2024.04.18
世界卫生组织(WHO)于 4 月 12 日发布《WHO 药用辅料 GMP — 附件 1 :药用辅料生产和控制的风险管理》指南草案,为药用辅料生产商、包装商和分销商提供指导,以确定可能对辅料的生产、控制、质量和纯度产生负面影响的风险和危害。
WHO 正在就该附件草案向公众征求意见,截止...
|

|
WHO 药用辅料GMP附件2:高风险辅料示例清单
2024.04.18
世界卫生组织(WHO)于 4 月 12 日发布《WHO 药用辅料 GMP — 附件 2:高风险辅料示例清单》,提供了高风险辅料和污染物的示例清单,以提醒此类辅料的生产商以及含有此类辅料的成品制剂生产商采取措施以确保此类辅料和成品制剂的安全性、纯度和质量。
WHO 表示该清单将不定期...
|

|
尼日利亚将PICS等严格监管机构认证列为审评必要条件
2024.01.15
尼日利亚食品药品监督和控制局(NAFDAC)于 2024 年 1 月 9 日发布公告表示,将加强对原料药(API)质量的监管,收紧 API 来源要求,从 2024 年 1 月起在尼日利亚提交的药品申报资料,只接受审评经过认可来源的 API 或制剂(FPP)支持的申请。
NAFDAC 表示,成品制剂生...
|

|
FDA 生产质量办公室主任谈辅料中苯和二甘醇污染问题
2023.05.10
美国 FDA 生产质量办公室主任 Francis Godwin 于 5 月 3 日在辅料世界会议上讲话,表达了对影响辅料行业的一些合规问题的关注。他表示,苯污染是一个“热门话题”,在质量领域引发了很多问题,另外,二甘醇(DEG)和乙二醇(EG)污染的产品越来越多。
Godwin 进一步指出,随着 ...
|

|
原辅料 OOS 结果调查应关注哪些方面的内容?
2023.04.05
美国 FDA 于去年 5 月发布了《药品生产中 OOS 检测结果的调查》修订指南,该指南同样适用于原料药(API)和其它原辅料以及成品制剂,但没有涉及到关于 API 和辅料的具体考量因素。
Lachman 咨询公司就 API 和辅料的 OOS 结果调查给出了以下考量建议:
1. 是否是重复...
|
|
WHO 发布药用辅料 GMP 指南草案
2023.03.29
世界卫生组织(WHO)于 3 月 23 日发布了关于药用辅料 GMP 的指南草案,为药品中所用辅料的生产、控制、贮存和分销提供指导,重点关注适当质量管理体系下的 GMP。
WHO 指出,由于辅料有时会在药品制剂中大量使用,并且辅料可能含有杂质,因此辅料会影响成品制剂的质量。制剂生...
|

|
FDA 就简化辅料数据库以及删除剂型信息公开征求意见
2022.03.23
美国 FDA 于 2022 年 3 月 21 日发布公告,就试图减少其辅料数据库(IID)中最大每日摄入量(MDI)和最大每日暴露量(MDE)限度的混淆问题以及是否应该从 IID 中删除剂型信息征求反馈意见。这是 FDA 根据仿制药使用者付费修正案(GDUFA II)简化药物数据库的承诺的一部分。
...
|

|
吐温 80 中的脂肪酸组成对治疗性蛋白质制剂稳定性的...
2021.12.06
聚山梨醇酯(吐温)辅料通常用作表面活性剂以稳定制剂中的治疗性蛋白质。吐温的降解可能导致药物制剂的颗粒形成和不稳定性。美国 FDA 药品审评与研究中心(CDER)以及食品安全和应用营养中心(CFSAN)的科学家们于 11 月 29 日发表在美国药学科学家协会(AAPS)期刊《药物研究》上的...
|

|
FDA 新型辅料审评试点获业界广泛支持,呼吁扩大资格...
2021.09.27
美国 FDA 于 9 月 7 日推出自愿参加的新型辅料审评试点计划,旨在为创新辅料的批准铺平道路。【FDA 启动新型辅料审评试点计划,促进开发和审批 2021/09/08】
尽管新型辅料在全行业范围内都具有优势,但申请人很少会因为一个辅料将其申报复杂化并冒有审批延迟的风险。因此,即...
|

|
FDA 启动新型辅料审评试点计划,促进开发和审批
2021.09.08
美国 FDA 药品审评与研究中心(CDER)于 9月 7 日推出了自愿性的新型辅料审评试点计划,这是制药商在将某些新辅料(非活性成分)用于药物制剂之前获得 FDA 审评的新路径。
新型辅料是指现有安全数据不完全支持当前建议的暴露水平、持续时间或给药途径的辅料。FDA 认识到辅料制...
|

|
FDA 辅料数据库更新,开始添加最大每日暴露量
2020.08.04
美国 FDA 于 7 月 29 日宣布已开始向辅料数据库(IID)中添加最大每日暴露量(MDE),预计将在 10 月之前完成。辅料行业组织对此表示支持,但希望 FDA 在完成 MDE 添加之前保留最大含量限度信息,否则可能会造成更多混乱。
MDE,也称为最大每日摄入量,是基于使用辅料的制...
|

|
业界热烈支持FDA新型辅料不关联审评试点并提出改进意...
2020.02.14
制药商和辅料供应商对于 FDA 新型辅料独立审评试点计划表示强烈支持,但同时也敦促 FDA 完善这一计划,澄清新型辅料的含义,并将该计划扩展到其它类型的辅料,例如食品中使用的辅料。
多年来,FDA 仅在研究用新药申请(IND)、新药申请(NDA)和生物制品许可申请(BLA)中审评新型...
|

|
FDA 拟启动新型辅料不关联审评试点计划
2019.12.06
美国 FDA 正在向业界征询有关通过独立审评程序来评估新型辅料安全性的试点计划的意见。业界支持者认为这一计划可以刺激急需新型辅料的发展。
辅料是在药品中使用并且有意添加的成分,但并不期望会产生治疗效果。新型辅料是从未使用过且“在 FDA 批准的药品中从未审评过或者未在食品...
|

|
原辅料元素杂质额外要求造成 FDA ANDA 审批延迟
2019.08.29
辅料供应商抱怨美国 FDA 对于辅料和原料药生产商检测物料中元素杂质的要求已经超出 ICH 和 USP 的要求,并且延迟了批准。
美洲国际辅料协会(IPEC-美洲)前任主席、杜邦营养和生物科学全球法规事务经理 Priscilla Zawislak 在 8 月 21 日 IPEC-美洲举行的网络研讨会上表示,...
|

|
FDA 将改进辅料数据库以包含最大每日暴露量数据
2019.07.16
美国 FDA 于 7 月 10 日发布《辅料数据库的使用》指南草案,解释了即将对 FDA 的辅料数据库(IID)开展的一些改进,包括将增加每种辅料的最大每日暴露量(maximum daily exposure,MDE)以及对数据库更频繁地更新。指南还介绍了如何使用 IID 及其局限性。
指南表示,“将根据GD...
|
|
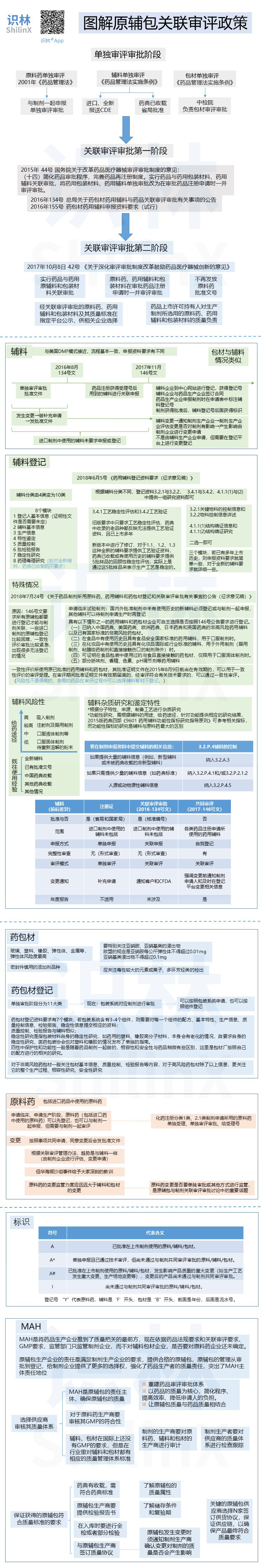
图解原辅包关联审评政策
2018.10.13
作者:识林-樟
识林®版权所有,未经许可不得转载。如需使用请联系 admin@shilinx.com 。
...
|

|
基于风险的辅料GMP评估指南将推出
2018.03.30
如何进行辅料的适当GMP的风险评估?国际药用辅料协会(IPEC)已发布了多个报告,包括NSF/IPEC/ANSI 363 – 2014 、NSF/IPEC/ANSI 363 - 2016 标准题目都是“辅料的GMP”。2017年3月IPEC欧盟分会和美国分会又联合发布了辅料生产商的风险评估,为辅料供应商提供风险评估...
|

|
OGD计划在处方相似性审评中隐藏更多信息
2015.05.24
某些特定的仿制药在同原研比对时,保证原料药和辅料成分“定性(Q1,qualitatively)定量(Q2,quantitatively)”相一致,可避免再进行体内药代动力学研究,或者基于临床终点的生物等效性试验。仿制药办公室过去允许企业针对特定品种(例如,滴眼液、部分外用产品以及某些液体制剂),提...
|
|
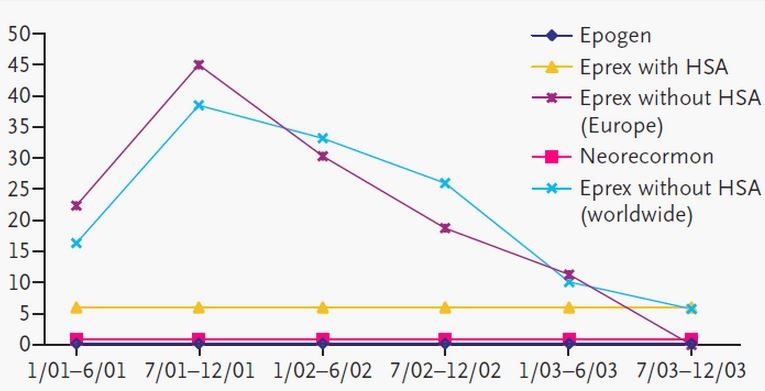
【旧闻】一例重组生物制品处方变更引发的风波
2015.04.07
1998年,由抗EPO抗体诱发的纯红细胞再生障碍性贫血(PRCA)发生率突然升高,且大多发生在皮下注射Eprex(EPO alfa)的慢性肾损伤患者身上...In 1998, an increase in the incidence of pure red cell aplasia (PRCA) was observed that was associated with anti-erythropoieti...
|

|
源于麻疯树甘油的毒性
2013.07.10
Potential Toxicity Associated with Oils, Glycerin, and Proteins Derived from the Jatropha Plant
July 20, 2012
Dear International Colleague
The United States Food and Drug Administration (FDA) is notifying industry and stakeholders of the potentia...
|