
|
FDA 发布人工智能文件,强调跨部门合作
2024.03.19
美国 FDA 于 3 月 15 日发布了题为“人工智能和医疗产品:CBER、CDER、CDHR 和 OCP 如何合作”的文件,概述了在整个医疗产品生命周期中开发和使用人工智能的具体重点领域。
这份 7 页的报告是 FDA 生物制品审评与研究中心(CBER)、药品审评与研究中心(CDER)、器械与放射健...
|

|
FDA 发布仿制药受控通信新指南,厘清更多细节
2024.03.18
2024 年 3 月 15 日周五,FDA发布《与仿制药开发相关的受控函》定稿指南,这次发布的指南是对 2022 年 12 月指南草案的定稿,取代了 2020 年 12 月发布的指南。
与草案相比,定稿指南的变化包括更新指南以澄清受控通信中封面函的作用;澄清提交受控通信的授权代理人应包括...
|
|
FDA 专家会支持强生传奇生物的Carvykti和BMS的Abecma...
2024.03.18
美国 FDA 肿瘤药专家会(ODAC)于 3 月 15 日对两款 BCMA 靶向 CAR-T 疗法 Carvykti(强生/传奇生物)和 Abecma(BMS)的讨论和投票结果已经出来,虽然两款药在各自的试验中显示出患者早期死亡的潜在问题,但专家们仍然认为这两个药的长期获益大于风险。
11名专家一致投票支持 ...
|

|
国内药政每周导读:上海探索生物药分段试点和长三角监...
2024.03.18
【CMC与仿制药】
3.12,【NMPA】关于发布仿制药参比制剂目录(第七十八批)的通告(2024年第11号)
【注册与审评审批】
3.17,CDE 药品审评报告和说明书更新,其中包括下列国产新药
【GXP与检查】
3.11,【四川省】关于公开征求《四川省药品生产许可快速审查审批实施...
|

|
【周末杂谈】标签与监管 – 处方药与 OTC 药
2024.03.17
药品监管的松紧,要与药品的使用联系起来看
处方药和非处方药(OTC),哪个监管得更严?对这个问题的回答,几天前,对笔者来说是显而易见的:当然是处方药严了。新药上市后多年,经过或不经过仿制药阶段,当其安全性和有效性得到了充分确认后,经企业申请和FDA批准,才能成为OTC药。而且O...
|

|
【识林新功能】识林变更管理工具上线试用
2024.03.16
https//lib.shilinx.com/index.php/moc/index/home 识林变更管理工具入口
药品生命周期,离不开变更;而变更流程之重,莫过于分级。
“这个变更,到底该是微小,中等,还是重大?”
这个问题决定了后续一系列工作,而问题的答案,是基于科学考量与法规依据之间的微...
|
|
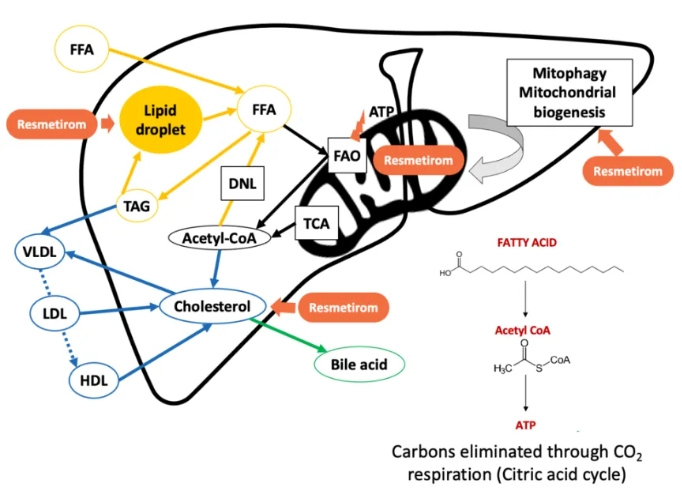
FDA 批准首个代谢功能障碍相关脂肪性肝炎药物
2024.03.15
美国 FDA 于 3 月 14 日加速批准了 Madrigal 药业 的 Rezdiffra(resmetirom)用于治疗中度至重度肝脏疤痕(纤维化)的成人代谢功能障碍相关脂肪性肝炎(MASH),也称为非酒精性脂肪性肝炎(NASH),结束了该病长达数十年没有有效治疗方式的现状。
FDA 药物审评与研究中心(CD...
|

|
欧盟委员会颁布法规简化变更流程,取消生物制品质量和...
2024.03.15
欧盟委员会(EC)于 3 月 11 日颁布授权立法,通过修订对上市许可变更法规的来改善药品生命周期管理。
欧盟立法者上次对变更监管框架进行重大修订是在 2012 年。委员会表示,自那时以来,总体变更数量增加,“耗尽了监管机构和行业的资源”。工作量的增加与进展相一致,这表明“...
|
|
FDA 公布2025财年预算提案,提出扩大检查和数据收集...
2024.03.14
美国 FDA 于 3 月 11 日公布了其 2025 财年 72 亿美元的预算提案,其中 37 亿美元的财政拨款,35 亿美元来自使用者付费资金,总体比 2023 财年的资金水平增加了 4.95 亿美元。根据最近公布的 2024 财年最终资金,预算提案比 2024 财年增加了 1.68 亿美元。
FDA ...
|

|
FDA 关注强生传奇以及BMS两款CAR-T骨髓瘤试验中的早...
2024.03.14
美国 FDA 将于 3 月 15 日召开肿瘤药专家会(ODAC)讨论两款 CAR-T 疗法研究的早期患者生存率的负面趋势“在临床获益的背景下是否可以接受”。
根据 FDA 为专家会准备的简报文件,FDA 对两项旨在将 CAR-T 疗法 Carvykti(强生/传奇生物)和 Abecma(BMS) 纳入多发...
|
|
FDA 更新早期阿尔茨海默病药物开发指南,增加对生物...
2024.03.13
美国 FDA 于 3 月 11 日发布“早期阿尔茨海默病:治疗药物的研发”修订指南草案,描述了 FDA 目前关于使用生物标志物来选择患有早期阿尔茨海默病参与者参加试验的想法。
该指南草案是 FDA 于 2018 年 2 月发布草案的修订版,是为考虑开发用于患者发展为明显痴呆之前的散发...
|

|
FDA 发布非处方药 NDA 和 ANDA 的年度报告标签变...
2024.03.13
美国 FDA 于 3 月 12 日发布了一篇题为“非处方药(OTC)新药申请(NDA)和简化新药申请(ANDA)可年度报告的标签变更”指南草案,就可能在年度报告中提交的 OTC NDA 和 ANDA 产品标签变更类型提供了建议。
FDA 批准 NDA 或 ANDA 后,申请人可以对已批准的申请进行变更,...
|

|
国际药政每周概要:欧盟卫生技术评估,DARWIN EU 真...
2024.03.13
【监管综合】
03.05【EU】关于实施欧盟卫生技术评估法规的公众意见征询
03.07【EMA】DARWIN EU®继续扩大其提供真实世界数据研究的能力
【注册、审评、审批】
03.04【FDA】MAPP 6025.6 Rev.1 审评质量管理规范:突破性治疗认定药品和生物制品的管理
03.04【FDA】MAPP ...
|

|
FDA 要求召开外部专家会讨论礼来阿尔茨海默药 donane...
2024.03.12
礼来于 3 月 8 日表示,美国 FDA 将召开外部专家会讨论其阿尔茨海默病药物 donanemab 是否应该获得批准。
Donanemab 在去年的 III 期试验中取得了成功,与安慰剂相比,阿尔茨海默病的进展速度减缓了 35%。但礼来表示,FDA 预计将召开专家会来审查该试验,并表示,FDA“希望进...
|

|
药物开发中尽早使用目标产品概况(TPP)可缩短开发时...
2024.03.12
独立非营利研究机构 RTI 的两位专家在 RAPS 国际监管战略会议上表示,申办人应利用目标产品概况(TPP)文件尽早总结药物开发计划的主要目标,并在以后将其用作产品标签的基础。
RTI 监管事务总监 Mark Levi 表示,使用 TPP 文件的优势在于,可以在药物开发过程中前瞻性地使用...
|

|
FDA 发布两篇有关突破性治疗认定的审评质量管理规范
2024.03.11
美国 FDA 于 3 月 4 日发布了两篇审评质量管理规范(Good Review Practice)政策与程序手册(MAPP)关于突破性治疗认定药品和生物制品的上市申请审评和管理。
两篇 MAPP 都是对已经有 10 年历史的旧文件进行更新。主要修订包括更新了当前的新药办公室(OND)组织结构、新的...
|

|
Amylyx肌萎缩侧索硬化症关键试验失败,FDA是否会撤销...
2024.03.11
Amylyx 公司于 3 月 8 日宣布,其肌萎缩侧索硬化症(ALS)新药 Relyvrio 在一项关键研究中未能击败安慰剂。现在的问题是,于 2022 年获批的 Relyvrio 是否应该完全从市场上撤销,以及 FDA 最初批准是否是个错误。
经过患者权益倡导者多年的压力,FDA 对治疗 ALS 等毁灭...
|

|
国内药政每周导读:分析数据解释处理,生长激素临床,...
2024.03.11
【本周拟实施/废止】
【创新药与临床开发】
3.1,【CDE】关于发布《生长激素制剂用于生长激素缺乏症临床试验技术指导原则》的通告(2024年第18号)
3.1,【CDE】关于发布《小儿便秘中药新药临床研发技术指导原则(试行)》的通告(2024年第19号)
【CMC与仿制药】
3...
|

|
【周末杂谈】啥价买啥货
2024.03.10
绝大多数美国药房愿意多花钱,采购质量高于GMP的药品
三天前识林资讯报道了美国药品质量检测公司Valisure最近向FDA递交了公民请愿书,称高温下含过氧化苯甲酰的治疗痤疮产品会释放致癌物苯,并要求FDA就此采取九项措施。毕竟这只是一家公司给FDA的公开信,难以想象FDA会全盘接受这些要...
|

|
【识林岗位知识地图】新增:生物制品注册,生物制品生...
2024.03.09
去年9月,识林推出“化药仿制药注册”,“化药新药注册”,“原料QA”,“无菌QA”4个岗位知识地图模板,今年,为进一步确保实用性,识林深入企业需求,与处在岗位一线的向导老师合作,共同推出“生物制品注册”,“生物制品生产”,“化学药QC”以及“商业QA”4个岗位知识地图。
生物...
|