|
ICH 公布以患者为中心的药物开发思考性文件意见征询...
2021.06.28
ICH 以患者为中心的药物开发(PFDD)思考性文件于 2020 年 11 月获得 ICH 大会批准【ICH 将着手制定以患者为中心的药物开发指南 2020/12/12】,确定了纳入患者观点可提高药物开发的质量、相关性、安全性和有效性,并为监管决策提供信息的关键领域。思考性文件还提出了制定新 IC...
|

|
ICH 计划制定使用真实世界证据的药物流行病学研究新...
2021.06.17
随着人们对使用真实世界数据(RWD)以更好地了解药物安全性的兴趣日益浓厚,ICH 考虑需要就该主题制定统一的指南。
最近于 6 月 2-3 日在线举行的 ICH 2021 年第一次大会上,ICH 大会成员支持需要就“利用真实世界数据进行药物安全性评估的药物流行病学研究的规划和设计一般...
|

|
FDA 启动全球仿制药集群,协调仿制药开发和监管方法
2021.06.17
为促进全球监管机构对仿制药开发的科学和监管方法的协调一致,美国 FDA 正在建立一个仿制药集群(Generic Drug Cluster)。
FDA 于 6 月 14 日在其社交媒体账户上宣布启动仿制药集群,新集群被描述为“在世界领先的监管机构中建立的第一个解决全球仿制药开发问题的论坛”,旨...
|
|
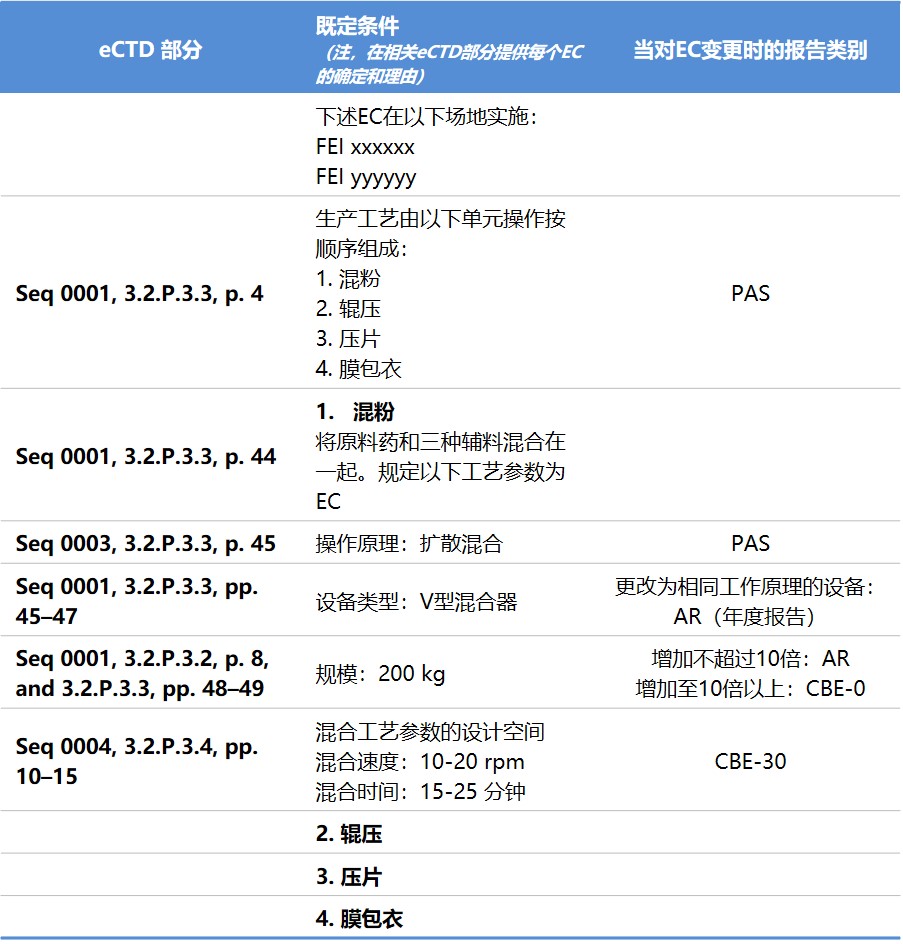
行业组织建议 ICH 降低对制造模型的监管监督,以期...
2021.05.27
最近几个行业组织共同制定了一项提案,用于管理对制药生产过程中使用的模型的监管监督,提出即使对于那些对药品生产有重大影响的模型也可以放松监管使用次要变更途径。
这几个行业组织分别是:BioPhorum、国际药物开发创新和质量联盟(IQ 联盟)以及制药过程分析圆桌会议(PPAR)。他...
|
|
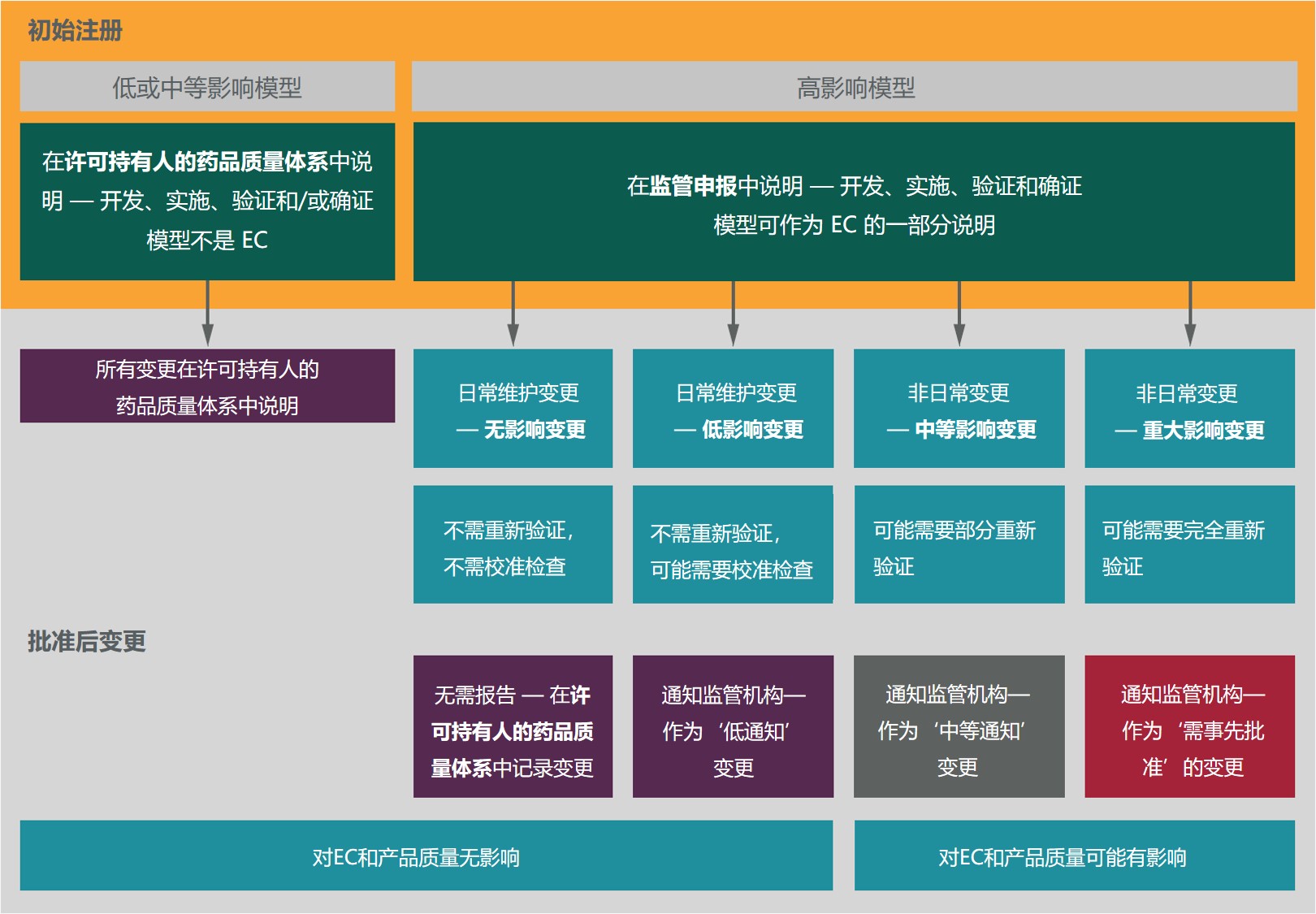
FDA 发布 ICH Q12 实施考量指南,详述如何实施既...
2021.05.26
美国 FDA 于 5 月 20 日发布《ICH Q12:FDA 监管产品的实施考量》指南草案,向制药商解释了如何在各类申请,包括新药申请(NDA)、生物制品许可申请(BLA)以及简化新药申请(ANDA)中提交既定条件(Established Conditions, EC),以及对 EC 的变更报告类别如何确定,以帮助制药商...
|
|
ICH 将于年底发布模型引导的药物研发(MIDD)概念文...
2021.05.25
监管机构对模型引导的药物研发(Model-informed Drug Development, MIDD)计划的兴趣日渐浓厚,但目前仍存在一些障碍,阻碍了 MIDD 计划的更广泛采纳。
美国 FDA 和加拿大卫生部于 5 月 14 日举办了 ICH 区域公开会议,提供了有关当前 ICH 主题的最新信息。会上辉瑞英国研发执行总...
|

|
【周末杂谈】ICH M9,创新与监管科学
2021.05.23
从CMC的角度看,创新药与仿制药的研制有那么不同吗?
5月11日,美国FDA发布了题为“M9 基于BCS分类的生物等效豁免(M9 Biopharmaceutics Classification System-Based Biowaivers)”。其实这就是ICH指导原则 M9。三年前,FDA就发布这个指南征求意见稿了。这次,几乎未作任何修...
|

|
ICH 发布药物致癌性试验指南附录,建议减少大鼠致癌...
2021.05.17
ICH 于 5 月 10 日发布了 S1B(R1)《药物致癌性试验指南附录》,提出了“证据权重”方法来指导为期两年的大鼠研究是否会增加评估药物致癌风险的价值。
拟议指南为正在考虑是否需要啮齿动物研究评估致癌性的药物开发人员提供了更详细的指导。2012 年 6 月,ICH 指导委员会批...
|

|
ICH 起草临床试验管理规范(GCP)指南现代化原则
2021.04.21
ICH 于 4 月 19 日发布了 E6(R3)临床试验管理规范(GCP)总体原则草案,这些原则将构成其修订 GCP 指南的基础。
ICH E6(R3) 专家工作组正在修订 E6(R2) GCP 指南,以期将 GCP 原则应用于越来越多样化的用以支持监管和医疗保健相关药品决策的试验类型和数据源,用...
|

|
使用 ICH Q12 方案简化分析方法的批准后变更,道阻...
2021.02.17
“人们普遍认为,PACMP 不会真正减少批准后的变更活动”
ICH Q12 指南实施工作组成员在 2 月 4 日的美国药典(USP)会议上表示,制药行业应利用 Q12 指南中有关批准后变更管理方案(PACMP)的规定促进分析方法的变更。
工作组成员、辉瑞工艺知识高级主管 Graham Cook 表...
|
|
ICH 将着手制定以患者为中心的药物开发指南
2020.12.12
ICH 正在就制定收集患者意见并将其纳入药物开发和监管过程的全球统一方法指南征求反馈意见,包括制定以对行业和监管机构都合理且可持续的方法收集患者观点的新的统一指南。
ICH 首先通过确定关键领域开启了这一拟议举措,ICH 认为收集患者意见可以改善药物开发的质量、相关性、安全...
|

|
辅料元素杂质数据库企业联盟:减轻 ICH Q3D 检测负...
2020.11.18
越来越多的制药商同意将他们对辅料元素杂质风险的认知汇总在一起,共同协助发展中央数据库,以更方便快速地实施 ICH Q3D 元素杂质指南所要求的风险评估。
11 月 10 日药品质量研究学会(PQRI)举办的关于 ICH Q3D 实施的会议上,辉瑞全球 GMP 分析总监 Laurence Harris ...
|

|
企业元素杂质风险评估有所改善,仍有进步空间
2020.11.14
最重要的是讲一个完整的故事
美国和欧盟监管机构在 ICH Q3D 元素杂质指南实施的过程中看到企业正在更好地执行风险评估。但是监管机构认为还有改进余地,有些评估没有把故事讲完整,缺少叙述性语言来支持数据分析,并导致监管机构需要提出不必要的问题,拖慢审评速度。
11 月 9...
|

|
ICH 将大幅修订 E19 安全性数据收集指南
2020.10.17
ICH 正在对其 E19 安全性数据收集的优化指南草案进行重大更改,该草案建议在药物安全性得到充分表征时,可以在某些上市前后期或上市后研究中选择性收集安全性数据。
默沙东的欧洲 QPPV Guy Demol 在 10 月 6 日至 8 日举行的 DIA 药物警戒受权人(QPPV)全球论坛上表示...
|
|
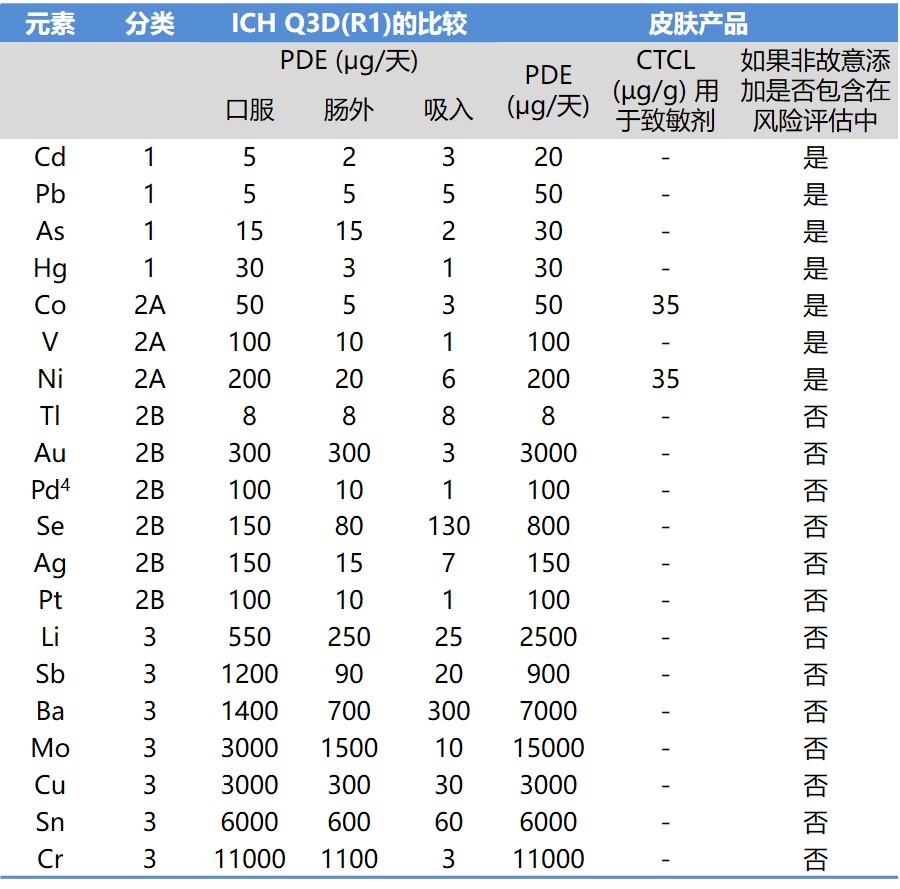
ICH Q3D 指南新增皮肤和透皮产品元素杂质限度附录
2020.09.28
ICH 于 9 月 25 日发布 Q3D 新附录 5 说明了关于皮肤和透皮给药路径元素杂质限度的考虑。附录介绍了如何通过将皮肤修饰因子(CMF)应用于每个元素杂质的肠外每日最大允许暴露量(PDE)来计算出所有相关元素杂质的皮肤 PDE。
附录适用于局部或全身作用的皮肤和透皮药品。不适...
|

|
ICH 质量指南修订计划:杂质、病毒安全性、风险管理...
2020.08.22
ICH 质量讨论组建议对 ICH 质量指南进行六项增补和修订,其中 ICH 管理委员会已经接受其中的四项修订工作,包括:病毒安全性评价、质量风险管理、可萃取物和可浸出物评估,以及通用技术文件质量综述。
讨论组报告员、辉瑞公司副总裁兼全球 CMC 负责人 Roger Nosal 于 8 月 ...
|

|
ICH Q14 分析方法开发草案将于明年初发布,关键信息...
2020.06.25
ICH 预计将于明年 1 月发布其 Q14《分析方法开发》指南草案,以建立分析方法的生命周期方法,并更新其 Q2(R2)《分析验证》指南以添加一些更新的分析方法。
Q14 的制定背景是,由于 ICH 目前没有关于分析方法开发的指南,因此申请人通常只报告分析验证结果,很少给出带有分析...
|

|
ICH 2020 上半年指南进展及计划中的新指南
2020.06.05
ICH 于 6 月 3 日发布新闻稿介绍了其在 5 月 27 日举行的网络会议的一些进展,包括增加了新的成员和观察员,并且更新了正在制定中的指南进程。这次网络会议代替了原定在加拿大温哥华举行的会议。
会上,ICH 首先欢迎了土耳其药品和医疗器械局(TITCK)成为监管成员,TITCK 于 ...
|
|
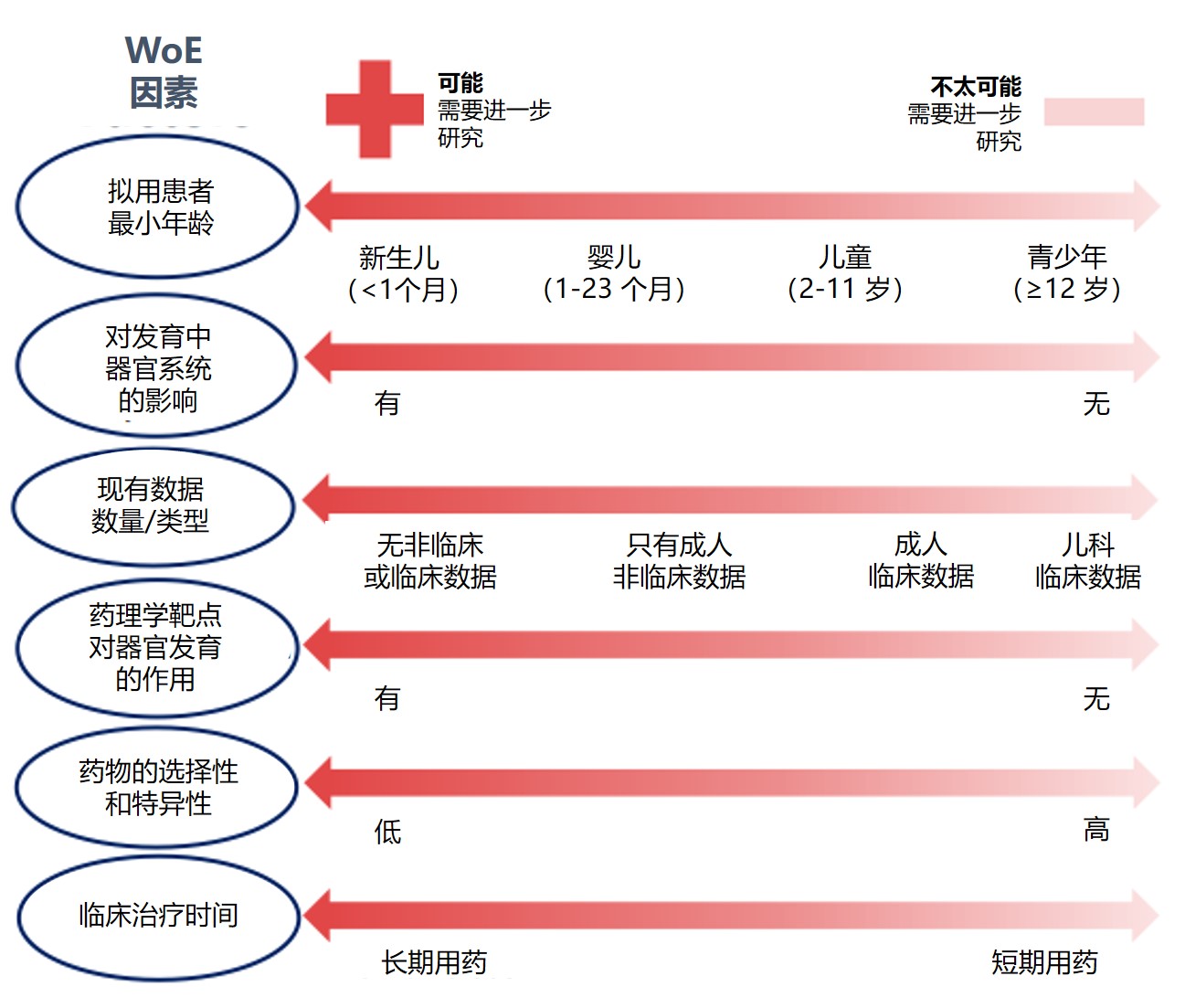
ICH 发布 S11 促进儿科试验并减少动物使用
2020.04.18
ICH 于 4 月 14 日发布 S11《支持儿科药物开发的非临床安全试验》定稿指南,阐明了关于何时以及如何通过非临床幼体动物试验支持儿科药物开发计划。
这份 39 页的指南于 2014 年首次由 ICH 指导委员会确定为指南主题,提出了针对 ICH 地区非临床儿科安全性测试的统一建议...
|

|
ICH 发布生殖毒性和发育毒性检测指南
2020.02.28
ICH 于 2 月 18 日发布 S5(R3)《人用药物生殖毒性和发育毒性的检测》定稿指南,在这份 127 页的指南中,ICH 为评估用于支持临床试验和药物批准的非临床发育和生殖毒性检测的协调方法提出了建议。该指南是 ICH 自 1993 年引入 S5指南以来的第三次修订。
ICH 表示,该指...
|