
|
【全文翻译】2024 年 FDA 新药审批总结报告
2025.01.10
美国 FDA 于 2025 年 1 月 8 日发布了其 2024 年度 FDA 新药审批总结报告。报告汇总了 FDA 药品审评与研究中心(CDER)去年一年中批准的所有新药、新用途和新使用人群以及生物类似药和可互换生物类似药、新配方和新剂型以及儿科人群扩展,概述了一系列值得注意的批准,提供了...
|

|
EMA 局长总结 2024 年药品监管工作
2024.12.19
欧洲药品管理局(EMA)局长 Emer Cooke 撰文总结了2024 年 EMA 在药品监管方面的工作成绩。她整体认为“2024 年的特点是高效、稳定的创新和监管网络内不可动摇的协作。”
2024 年 EMA 推荐了 114 个人用新药,其中 48 个含有全新的活性成分,16 个用于治疗罕见病。这是自 20...
|

|
【全文翻译】2023 年 FDA 新药审批总结报告
2024.01.10
pdf
美国 FDA 于 2024 年 1 月 8 日发布了其 2023 年度 FDA 新药审批总结报告。报告汇总了 FDA 药品审评与研究中心(CDER)去年一年中批准的所有新药、新用途和新使用人群以及生物类似药和可互换生物类似药、新配方和新剂型以及儿科人群扩展,概述了一系列值得注意的批准,提...
|

|
研究显示 FDA 持续放宽新药批准证据标准
2023.08.10
根据对 2022 年批准证据的最新分析,FDA 正在持续降低新药申请的批准标准。根据 8 月 8 日发表在《美国药学会杂志》(JAMA)的一封题为“支持 2022 年美国 FDA 药品批准的证据审查”的研究信,FDA 在过去几年中持续使用不太严格的新药批准标准。
研究者评估了支持 FDA 在 20...
|

|
2022年美国的肿瘤药物批准:注重总生存期、剂量优化及...
2023.03.02
本周FDA肿瘤卓越中心主任Richard Pazdur,血液肿瘤办公室主任Nicole Gormley和临床审评员(淋巴瘤)Deepti Telaraja,在《Nature reviews clinical oncology》上发表了一篇评论,总结了2022年美国的肿瘤药批准。在2022年,FDA批准了多种新的药物和生物制品,其中包括靶向小分子药物...
|

|
【全文翻译】2022 年 FDA 新药审批总结报告
2023.01.12
pdf
美国 FDA 于 2023 年 1 月 10 日发布了其 2022 年度 FDA 新药审批总结报告。报告汇总了 FDA 药品审评与研究中心(CDER)去年一年中批准的所有新药、新用途和新使用人群以及生物类似药和可互换生物类似药、新配方和新剂型以及儿科人群扩展,概述了一系列值得注意的批准,...
|

|
【全文翻译】2021 年 FDA 新药审批总结报告
2022.01.10
美国 FDA 于 2022 年 1 月 6 日发布了其 2021 年度 FDA 新药审批总结报告。报告汇总了 FDA 药品审评与研究中心(CDER)去年一年中批准的所有新药、新用途和新使用人群以及生物类似药和可互换生物类似药、新配方和新剂型以及儿科人群扩展,概述了一系列值得注意的批准,提供了...
|
|
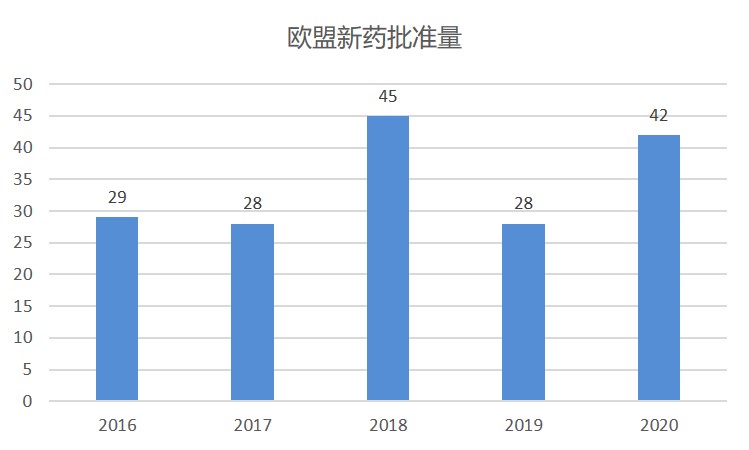
2020 年欧盟新药批准情况一览
2021.01.20
2020 年,欧洲药品管理局(EMA)总共有包含 41 个新活性成分的 42 个新药产品,与 2019 年许可的 28 个含新活性成分的产品相比有大幅增加,略低于 2018 年的 45 个。
去年值得注意的获批产品包括首款用于 COVID-19 的疫苗 — 辉瑞/BioNTech 公司的 Comirnaty,以及吉利德(...
|

|
2018-2020 年 FDA 新药审批报告回顾
2021.01.18
美国FDA日前发布了2020年的新药审批报告(识林进行了全文翻译)。2020年FDA的药品审评和批准面临许多挑战,包括设施检查、远程专家会议、居家办公等,但CDER仍然批准了多个创新疗法。回顾2018-2020年的新药审批报告,能够看出FDA鼓励企业创新以解决患者需求的态度。
Woodcock博士在202...
|

|
【全文翻译】2020 年 FDA 新药审批总结报告
2021.01.12
美国 FDA 于 2021 年 1 月 8 日发布了其 2020 年度 FDA 新药审批总结报告。报告汇总了 FDA 药品审评与研究中心(CDER)去年一年中批准的所有新药、新用途和新使用人群以及生物类似药、新配方和新剂型,概述了一系列值得注意的批准,提供了许多 CDER 批准的新治疗药物促进患...
|
|
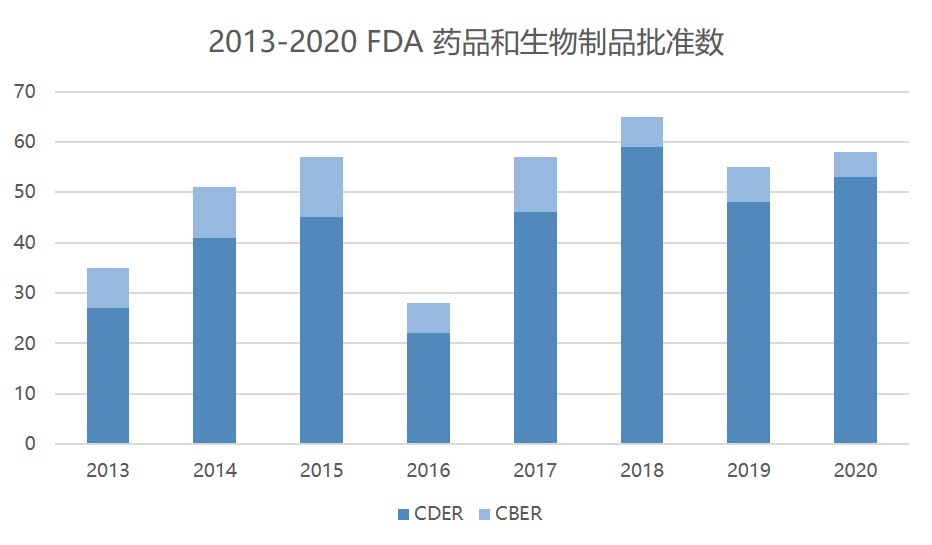
FDA 2020 年药品和医疗器械重点工作回顾
2021.01.04
美国 FDA 在 2020 年总共批准了 50 多个新药,即使是在没有新冠(COVID-19)疫情的年份也是一份卓有成效的成绩单。批准总数不仅超过了 2019 年(48 个新药)的成绩,也是 FDA 自 2018 年(59 个)以来第二次超过 50 个新药批准。
2020 年,药品审评与研究中心(CDE...
|

|
支持 FDA 药品批准所需关键临床试验数量呈下降趋势
2020.04.24
纵观过去 30 年间美国 FDA 对新药和生物制品的批准,越来越多的批准使用加快审评程序,并且所需关键试验有所减少。
4 月 21 日发表在 JAMA Network Open 上的一篇研究文章《1995-2017 年支持美国 FDA 新药批准的临床试验评价》1汇总了 1995-2017 年间 FDA 批准的 2...
|

|
FDA 受新药办公室改组影响的申请
2020.01.21
Applications Affected by the Reorganization of the Office of New Drugs
+
Applications
OND Reorg affected applications p3 (XLS - 2MB)
The approved restructuring of the Office of New Drugs (OND) creates offices that align interrelated disease ...
|

|
【周末杂谈】读纽约时报社论:困境中的FDA
2020.01.19
2020年1月11日,美国纽约时报发表社论“困境中的FDA。如何改进 - 对新局长的工作建议”(The FDA Is in Trouble. Here's How to Fix It - Some New Year’s resolutions for the incoming boss),对FDA近年来的一些所作所为,提出了尖锐的批评。请注意,纽约时报...
|
|
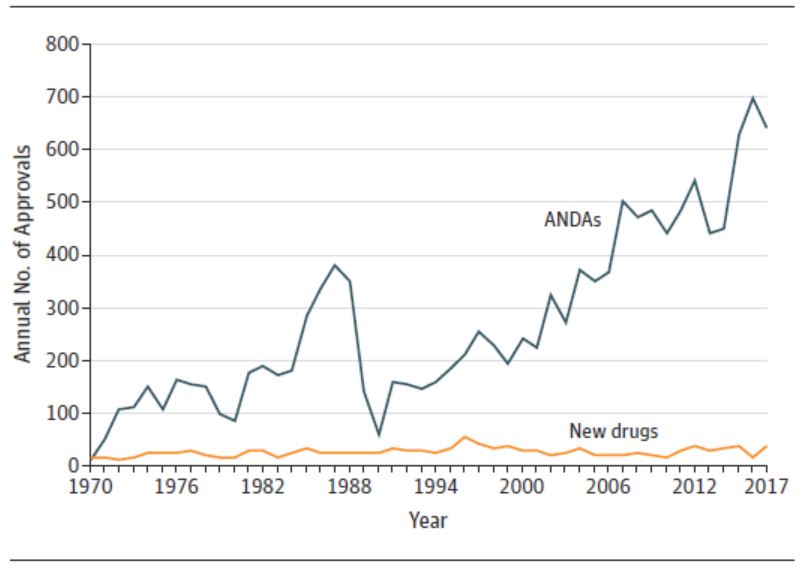
过去四十年 FDA 新药审批改革成效如何,需再次改革...
2020.01.16
1 月 14 日发表在 JAMA 上的一篇题为“1983-2018 FDA 药品批准和监管”的通讯文章引发了业界的广泛关注,文章认为美国 FDA 在过去四十年中进行的加快审评的改革可能需要进一步做出改变。文章作者为哈佛医学院布莱根妇女医院医学系的 Jonathan Darrow 等人。
总体而言,文章...
|
|
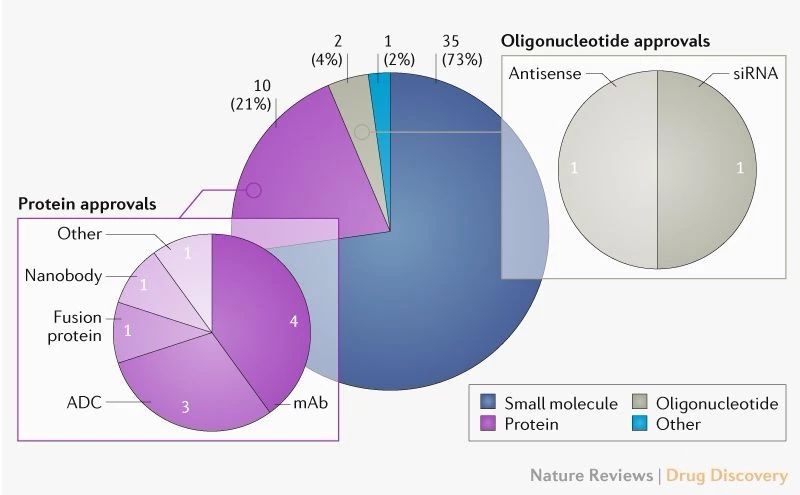
【转载】Nature子刊:2020年FDA可能批准的新药
2020.01.14
2019年,FDA 的药品评价与研究中心(CDER)共批准了48款新药上市,虽然数量上低于2018年的59个,但是这个数字仍是过去25年的第3高。FDA最近连续5年的平均批准新药数量达到了44个,这个数字是2005-2009年平均批准新药数量(22个)的2倍。
FDA在新药审批方面给予的政策激励也能解释...
|

|
【全文翻译】2019 年 FDA 新药审批总结报告
2020.01.11
美国 FDA 于 2020年 1 月 6 日发布了 2019 年度新药审批总结报告,报告汇总了 FDA 药品审评与研究中心(CDER)去年批准的所有新药、新用途和新适用人群,以及生物类似药、新配方和新剂型药物,概述了一系列值得注意的批准,提供了许多 CDER 批准的新治疗药物促进患者健康的有...
|

|
2019年 FDA新药审批总结
2020.01.06
Innovation in New Drug Approvals of 2019 Advances Patient Care Across a Broad Range of Diseases
In 2019, the FDA approved a wide variety of new drug therapies to help patients in need.
2019年创新型新药批准推动了一系列疾病的患者...
|

|
药业的 2010 年代:加速、创新和充满争议的十年
2020.01.03
回顾二十一世纪的第一个十年,我们应如何评判这十年间的制药业?十年的时间跨度不可避免的充斥着成功与失败、飞跃与绝境、协调与冲突,下面我们看看总部在伦敦的全球大型出版商 Informa 的撰稿人 Andrew McConaghie 对这十年制药行业的总结分析。
癌症、丙型肝炎、罕见疾病方面的...
|

|
【周末杂谈】鼓励创新药发展的政策环境
2019.12.22
药价没有最低,只有更低,非中国首创,也许这会让一些锐意创新的朋友们失望了。上周一识林资讯报道了一项FDA的市场调研结果,显示美国市场上仿制药的价格竞争惨不忍睹【FDA 新研究证明有六个竞争者的仿制药价格降幅超九成】。简言之就是,第一个仿制药出现时,价格比品牌药降三成,待第六...
|