
|
EMA 拟认定 PBPK 建模平台 Simcyp,可预测药物相...
2025.06.18
5月7日,欧洲药品管理局(EMA)发布其下属的人用药品委员会(CHMP)对Simcyp 模拟器(Simcyp Simulator)V19R1(以下简称Simcyp V19)的认证意见草案。EMA允许企业按照使用场景(CoU)以及良好实践建议将Simcyp V19用于新药的药物相互作用(DDI)风险评估,此时可在注册申报中引用该...
|

|
国际药监联盟 IPRP 马德里会:继续推动全球监管协调
2025.06.18
5月14日至15日,国际药品监管机构计划(IPRP)管理委员会第15次会议在西班牙马德里举行。可能是考虑到与会监管机构的方便,该会议选择与ICH马德里大会在同一城市的相近时间举行。
此次会议汇聚了来自全球的31个IPRP成员和观察员,共同探讨药品监管领域的最新进展和未来发展方向,并展示...
|

|
EMA 2024年报:新药批准,真实世界与人工智能
2025.06.17
6月10日,欧洲药品管理局(EMA)发布了2024年报,详尽阐述过去一年的工作与成就。浏览年报可见,除了必不可少地宣示自己在新药审评方面成就斐然,EMA还单独辟出板块介绍真实世界数据应用与人工智能,昭示着其接下来的监管科学发展导向。
现将这三个部分的要点总结如下。也可阅读报告...
|
|
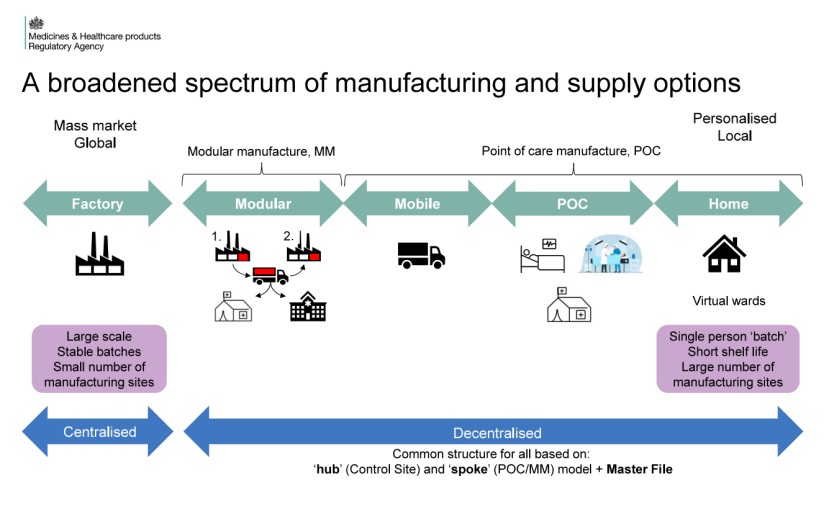
MHRA 发布7份系列指南,支持全球首个去中心化制造监...
2025.06.17
6月11日,英国药品和健康产品管理局(Medicines and Healthcare products Regulatory Agency,MHRA)宣布,为即将于7月23日生效的全球首个去中心化制造(Decentralized Manufacturing,DM,曾译为分散式制造,现参考我国官方对去中心化临床的翻译)框架,发布了七份指南文件,涵盖...
|

|
国际药政每周概要:MHRA 发7份去中心化制造指南,FDA...
2025.06.17
【早期开发与临床】
6.12,【EMA】HMA-EMA 真实世界数据来源和研究目录的用户指南
【注册审评】
6.10,【EMA】根据法规(EC)726/2004条款57(2)引入的法律要求提交的药品数据的质量控制
6.12,【EDQM】CEP 认证程序行为准则
6.13,【FDA】ANDA:与优先仿制药申报相...
|

|
现场研学课 接轨 PICS 对我国药业 GMP 实践的影...
2025.06.16
随着我国加入PIC/S的进程持续推进,药监部门在积极强化检查能力和体系建设,《无菌药品附录(征求意见稿)》也已发布。建立与PIC/S接轨、具有国际竞争力的生产质量体系,既是国际化药企开拓全球市场的必备条件,也是本土药企在激烈竞争中求生和发展的核心需求。
6月23-25日,在杭州,IP...
|

|
Sarepta 基因治疗载体获首个 FDA “平台技术”认定
2025.06.16
6月4日,Sarepta Therapeutics宣布其基因治疗载体获得FDA的“平台技术(Platform Technology)”认定。
基因治疗药物研发和上市过程面临着诸多挑战,其中一个关键问题是,实验性治疗往往共享某些组分,如用于递送治疗基因的病毒载体。这些组分的安全性和有效性需要在每个单独的治疗...
|

|
国内药政每周导读:化药药学变更管理方案,先进治疗药...
2025.06.16
【注册与变更】
6.9,【CDE】关于公开征求《化学药品批准后药学变更管理方案技术指导原则(征求意见稿)》意见的通知
6.11,【CDE】常见一般性技术问题解答 - 新增1个问答
【监管综合】
6.9, 【国务院】关于进一步保障和改善民生 着力解决群众急难愁盼的意见
6.10...
|

|
【周末杂谈】大模型推理的局限性
2025.06.15
LLM和LRM随着任务复杂度的增加,会完全丧失推理能力
十天前,苹果公司的研发团队发布了一篇AI研究论文。不愧是出自苹果之手,无论是新颖的方法论,让人意想不到的结果和结论,还是论文写作的精炼和插图的精美,都令人耳目一新。
笔者非AI专家,难以专业地对论文说三道四。下面只是对论...
|

|
【识林新文章】第6期药审云课堂问答,化药受理要点,F...
2025.06.14
在官方法规指南之外,识林或原创、或整理了大量对比解读、案例解析等内容,作为识林用户的参考资料,提供更多视角,与岗位实务联系更为紧密。
这类资料,全部收录在专门为此开发的“对比解读案例解析”数据库内,通过“业务标签”和“知识标签”的交叉索引,用户可迅速查阅学习本岗位最...
|

|
FDA 调整 K 药 O 药胃癌和食管癌适应症,限于 PD...
2025.06.13
FDA于2025年5月22日和23日分别向默克(Merck)和百时美施贵宝(Bristol Myers Squibb,BMS)发出信函,要求调整其药物的适应症标签。调整后的适应症明确Keytruda(帕博利珠单抗)和Opdivo(纳武利尤单抗)仅适用于PD-L1阳性的转移性胃癌、胃食管结合部(GEJ)癌和食管癌患者。这意味...
|

|
EMA 将严重眼部疾病定性为司美格鲁肽“非常罕见”的...
2025.06.13
6月6日,EMA宣布,诺和诺德(Novo Nordisk)的司美格鲁肽产品Ozempic、Rybelsus和Wegovy的产品信息需要更新,以将一种严重眼部疾病列为“非常罕见”的副作用。
司美格鲁肽是一种GLP-1受体激动剂,被广泛用于治疗2型糖尿病和减重,市场表现极佳。近年来,多项研究探讨了GLP-1类药物...
|

|
【全文翻译】 FDA 局长文章《新 FDA 的优先事项》
2025.06.12
6月10日,FDA局长Makary(与新任CBER主任Prasad共同署名)在《美国医学会杂志》(JAMA)发表题为《新FDA的优先事项》(Priorities for a New FDA)的文章,第一次全面而系统地阐述自己的“施政纲领”。
自特朗普再次上台以来,FDA几乎一直处于预算削减人员裁撤、管理方式大幅转变...
|

|
FDA 拟将药品着色剂上市后变更降为中等
2025.06.12
5月29日FDA发布了针对药品着色剂变更的草案指南。一般情况下,此类变更现将被视为中等变更,提交“30天内生效变更”(Changes Being Effected in 30 days,CBE-30)即可。
早在1997年2月发布的《速释制剂扩大规模或上市后变更指导原则有关事项的问题和解答》(SUPAC-IR Questions an...
|

|
哈佛报告示警,五大新兴技术中,中国生物技术最接近超...
2025.06.11
6月5日,哈佛大学贝尔弗科学与国际事务中心(Harvard Belfer Center for Science and International Affairs)发布了一份全球技术地缘政治文件《关键新兴技术指数报告》(Critical and Emerging Technologies Index)。报告指出,在人工智能、生物技术、半导体、航天和量子技...
|

|
取消兔热原检测后怎么办?EMA 发布相关问答
2025.06.11
5月27日,EMA近期更新了药品质量问答,新增了对取消兔热原检测(家兔法)后变更管理的建议。
欧洲药典取消兔热原检测方法
EMA在2025年2月发布了一份思考性文件,阐述了欧洲药典和人用药委员会不同工作组(如非临床工作组、疫苗工作组等)对替代、减少和优化(3R)原则实施的思考,...
|

|
FDA 圆桌会探讨放宽 CGT 监管,“中国”字眼屡被提...
2025.06.10
6 月 5 日,在FDA举办的细胞和基因治疗(CGT)圆桌会议上,多位行业专家呼吁 FDA 放宽对基因治疗早期临床试验的监管,以确保美国在该领域的创新优势不被中国超越。
虽是FDA组织的会议,且议题原本仅限于CGT,但包括卫生部长小肯尼迪,美国国立卫生研究院(NIH)主任Bhattacharya...
|

|
BPOG 发布问答文件指导 PUPSIT 实施
2025.06.10
4月,BPOG发布了一份题为《解读附录1:关于除菌过滤的见解 - 常见问题》(Navigating Annex 1 Sterile filtration insights FAQs)的文件,以问答形式总结了其团队在2023年和2024年会议中最常讨论的要点。其中多个问答针对PUPSIT(pre-use post sterilisation integrity te...
|

|
国际药政每周概要:FDA 发布 AI 工具 Elsa ,非...
2025.06.10
【早期开发与临床】
6.4,【EMA】皮下和/或肌肉注射用普通人免疫球蛋白(SCIg/IMIg)的临床研究指南
6.6,【PMDA】抗微生物药耐药的革兰氏阴性细菌感染治疗药物临床开发需考虑的要点(早期考虑)
【注册审评】
6.4,【FDA】符合“关于微小变更的非处方药专论程序 C001:某...
|

|
FDA 审评考量与申报路径选择:Elamipretide 案例的...
2025.06.09
5月29日,FDA向Stealth Biotherapeutics公司发出了关于其巴特综合征(Barth syndrome)治疗药物Elamipretide的完全回应函(Complete Response Letter,CRL),拒绝其新药申请(NDA)。此前在2024年咨询委员会上,专家以10-6的投票结果认为Elamipretide的疗效已经得到证明。更早之前的2...
|