
|
FDA 渐成游说目标,政治影响力渗透药品监管
2026.03.12
近期美媒STAT发布一篇调研报告,基于对十位知情人士的访谈,得出的观点是特朗普政府将政治优先事项注入这个长期免受此类干预的机构,为行业游说开辟了新的途径。而制药行业正试图利用这一变化。受访者包括游说者(lobbyists)、顾问、FDA官员以及参与相关行动的企业高管。
以下内容均源...
|

|
2026年 FDA 药品指南计划:生产质量 AI,临床 DHT...
2026.03.12
2月24日,FDA药品审评与研究中心(CDER)公布了2026年指南发布计划。该计划通常每年发布年初和年中两个版本,包含FDA药品监管领域的最新动态,为行业提供可预测性。
这份计划涵盖12个类别81份指南文件。其中几个监管趋势值得关注:
新兴技术的实质性合规化,AI与数字化应用正从概...
|

|
豁免美国参照药 PK 桥接,FDA 进一步简化生物类似...
2026.03.11
3月9日,FDA发布一份问答形式指南草案,再次采取行动简化生物类似药研发程序。此次调整的核心在于,不再强制要求比较拟申报生物类似药、美国参照药以及外国参照药的三组药代动力学(PK)桥接研究。
申办者可改为提交科学论证,说明使用外国参照药的临床比对数据何以支持与美国参照药...
|
|
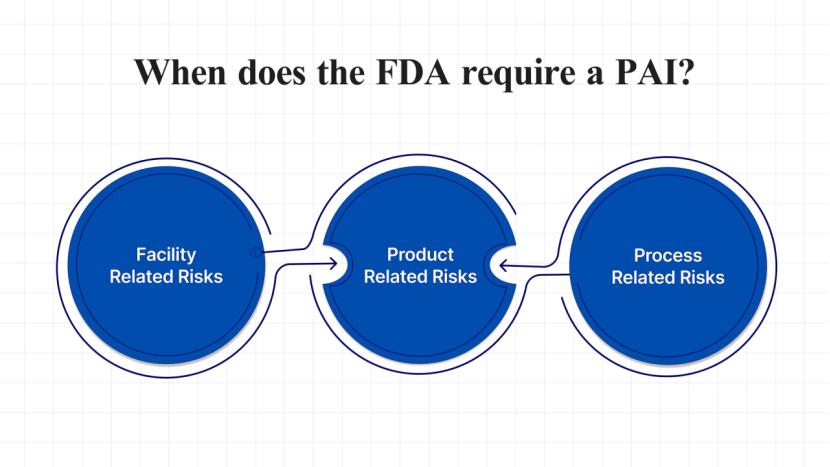
业界质疑 FDA 检查“潜在官方行动指示”拖延审批
2026.03.11
行业人士质疑FDA使用“潜在官方行动指示”(pOAI)状态作为签发完全回应函(CRL)的依据。FDA此举可能表明该机构难以应对其药物申请工作量,尤其是在过去一年中人员大量流失的情况下。
识林曾报道,FDA在2025年公布的第二批89份CRL中,有一半新药仅因为CMC和质量缺陷被拒批。另有一篇...
|

|
国际药政每周概要:FDA 发483回复指南,拟修订 SUPA...
2026.03.11
【非临床与临床研究】
3.2,【EMA】关于制定基于微生物组的药品的非临床开发与评价的思考性文件的概念性文件
3.2,【EMA】囊性纤维化治疗药品临床研究指南
3.3,【EMA】临床领域3年综合工作计划
3.4,【EMA】公共卫生突发事件期间临床试验实施指南
【注册与变更】
3....
|

|
2026年 EMA 临床指南规划体现监管和促进重心
2026.03.10
3月3日,EMA发布《临床领域3年综合工作计划》,罗列2026到2028计划制定的共计42份指南类文件,包括思考性文件和问答文件。
从标题可以看出EMA近期的临床开发与监管的涵盖面。
在神经系统疾病方面,重点涉及偏头痛、双相情感障碍、帕金森病、阿尔茨海默病、重症肌无力及肌萎缩侧索硬...
|

|
EMA 总结2024年度 GCP 检查,分享缺陷实例
2026.03.10
近日,EMA发布了《药物临床试验质量管理规范(GCP)检查员工作组(IWG)2024年度报告》,该报告涵盖67次检查(52次常规、15次有因检查),涉及临床研究者(62.7%)、申办者(26.9%)和合同研究组织(CRO)(7.5%)等参与方,主要分布在亚洲(32.8%)、北美(25.4%)和欧盟/欧洲...
|

|
FDA 发483回复指南:从内容,签字到管理责任落实
2026.03.09
3月6日,FDA发布了题为《回复药品 CGMP 检查结束时的 FDA 483 表观察项》的指南草案,为药品生产企业在收到FDA 483表后如何回应提供建议,内容涵盖回复文件的结构、内容要素、处理缺陷项的技术考量以及未完成整改时的沟通机制。
无独有偶,国家局CFDI刚于2月27日发布《药品生产...
|

|
Prasad 将于4月底离职,FDA 公开其争议性邮件
2026.03.09
FDA于3月6日确认,生物制品审评与研究中心(CBER)主任Vinay Prasad将于4月底离职。
FDA局长Marty Makary一贯对Prasad评价颇高且多次联名发表文章,他的措辞显得这次变动“自然而然”。在一次采访中,Makary表示,Prasad此前从加利福尼亚大学旧金山分校调入FDA时,本就只计划任职一...
|

|
国内药政每周导读:mRNA 疫苗临床指南,肿瘤药 BE 和...
2026.03.09
【非临床和临床研究】
3.4,【CDE】关于发布《慢性鼻窦炎伴鼻息肉治疗药物临床试验技术指导原则》的通告(2026年第17号)
3.4,【CDE】关于公开征求《预防用 mRNA 疫苗临床试验技术指导原则(征求意见稿)》意见的通知
3.5,【CDE】关于发布《抗肿瘤药物生物等效性及药代...
|

|
【周末杂谈】对有效性和安全性的不等待遇
2026.03.08
从临床试验3年独占期的政策上看FDA的重创新、轻风险
新化合物的新药,可享有5年临床数据独占期,期间FDA不受理仿制药申报。对已批准化合物,补充进行临床试验并获得改良新药批准的,可享有3年市场独占期,期间FDA不批准仿制药申报。这些似乎都是清楚的内容。但世上怕就怕认真二字。加做临...
|

|
【识林向导招新 2026】分享知识,获取账号,共建识林...
2026.03.07
Hi,亲爱的识林用户
识林基于药业结构化专业知识库,结合AI技术,提供全球药业监管及产业实践解决方案的一站式服务。
识林社区是依托于知识库的专业知识交流平台,有问有答有探讨,并且向所有用户开放。
识林向导来自药企一线,基于所学知识和丰富经验,回答问题分享心得,帮助识...
|

|
适配 Q9 和 Q12,FDA 拟全面修订 SUPAC 系列指...
2026.03.06
3月3日,FDA发布联邦公告,就“工艺放大和批准后变更”(SUPAC)系列指南文件的修订征求公众反馈,旨在评估其与ICH《Q9(R1):质量风险管理》指南以及关于批准后变更的《Q12:药品生命周期管理的技术和监管考虑》指南的适配性,解决潜在的冲突或覆盖问题。
此次征求意见的通知共涉及...
|

|
FDA 拟澄清新临床研究3年专营权,改良药仍有机会
2026.03.06
3月3日,FDA发布了一份题为《药品的新临床研究专营权(3年专营权):问答》的指南草案,澄清药品申办者获得3年市场专营权的具体要求,旨在鼓励已获批药品的生命周期管理,涵盖新适应症、剂型、规格及给药方案的保护。
这份14页的指南草案以问答形式呈现,共包含18个问题。内容与业界...
|

|
欧盟新药法引入“平台上市许可”和“平台主文件”
2026.03.05
欧盟新药品立法已步入最后阶段,预计将于2026年内正式获得采纳并开启两年过渡期。此次立法修订被视作过去二十余年来欧盟制药行业监管框架最重大的变革。
根据欧盟委员会近日披露的信息,新框架将引入两种新的监管路径,以更灵活、创新的方式管理平台技术。这两种路径分别为平台上市许可...
|

|
聚焦 AI 与药品监管:HMA-EMA 小组召开行业利益相...
2026.03.05
2月4日,由欧洲药品管理局(EMA)和药品机构负责人(HMA)联合成立的人工智能(AI)行业利益相关者小组举行了线上会议。本次会议旨在促进监管机构与行业之间的开放对话,讨论AI在整个药品生命周期中的应用。会议介绍了国际AI指导原则的合作进展,探讨了《生物技术法案》对未来AI监管框架...
|

|
FDA 应用监管科学处聚焦新方法学(NAM)替代动物试验
2026.03.04
2月25日,FDA发布《应用监管科学处2025年度报告》,作为隶属于转化科学办公室(OTS)临床药理学办公室(OCP)的核心科学部门,应用监管科学处(DARS)在2025年度聚焦于新方法学(NAM)的开发与应用,在心脏/肺部NAM模型、罕见变异体及药物组合评估等领域取得系列进展,并为药品审评提供...
|

|
EMA 定稿非致突变杂质控制策略,补充 ICH Q3 并推进...
2026.03.04
征求意见1年后,EMA于2月2日正式发布《关于非致突变杂质的界定的思考性文件》,为非致突变杂质(Non-Mutagenic Impurities, NMI)的控制提供了详尽的参考框架,补充了ICH Q3A和Q3B指南在药品上市后出现超标杂质的监管缺口,并明确倡导采用新方法学(New Approach Methodologies, ...
|

|
多年酝酿后,美国医院和医生名录预计于年内上线
2026.03.03
据STAT独家报道,美国联邦政府近日披露,酝酿多年的“国家医疗提供者目录”(National Provider Directory)将在今年晚些时候进入初步测试阶段。
这一信息隐藏在医疗保险和医疗补助服务中心(Centers for Medicare and Medicaid Services,CMS)针对医疗保险优势计划(Medicare Adv...
|

|
EFPIA 比较10国生物制药战略,中美成欧洲标杆
2026.03.03
欧洲制药工业协会联合会(EFPIA)近期发布了一份题为《10个国家生物制药战略的比较分析》的报告。该报告在审视欧洲当前面临的地缘政治与经济压力背景下,对比分析了全球10个国家在生物制药领域的支持政策与战略布局。报告指出,生物制药行业与人工智能(AI)、量子技术同属全球创新与工...
|