|
首页
>
资讯
>
数据可靠性-从Ranbaxy说起
出自识林
2015-05-21 FDA等
2015年4月1日,太阳制药宣布完成对Ranbaxy的收购,Ranbaxy从印度股票市场退市。
成立于1961年的Ranbaxy,曾一度是印度最大的仿制药生产商,每年向美国提出几十个仿制药申请。但自2006年的Paonta Sahib场地在FDA现场检查时发现严重的cGMP违规,收到警告信以来,已经先后有Dewas、Mohali、Toansa等4个场地发现与数据可靠性(Data Integrity)有关的缺陷,被FDA采取警告信(Warning Letter)、进口禁令(Import Alert,简称IA)、注册诚信政策(Application Integrity Policy,简称AIP)等监管措施限制生产、出口至美国以及撤销ANDA申请,原本拿到的埃索美拉唑镁肠溶胶囊(ANDA 077830) 和盐酸缬更昔洛韦片(ANDA 078078)的美国首仿也被FDA取消了。特别是在2012年1月,FDA与Ranbaxy达成“合意判决(Consent Decree,简称CD)”,将Paonta Sahib、Dewas场地列入,并在2013年9月和2014年1月分别追加Mohali、Toansa场地(现场检查后未给警告信,直接IA和CD)。2013年5月,Ranbaxy被认定为有罪,并处总计5亿美元的赔偿金和罚款(其中1.5亿美元为刑事责任罚款)。
2006年-2014年对Ranbaxy各场地采取的监管措施
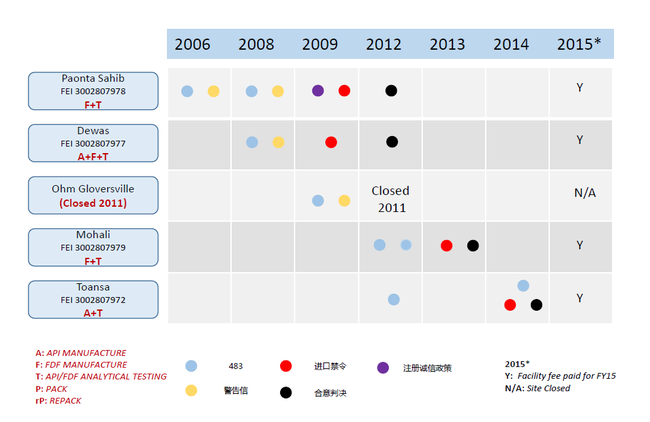
|
Paonta Sahib, Dewas, Mohali与Ohm子公司Gloversville场地现场检查发现的缺陷(警告信或483)
| Paonta Sahib 2006
|
| Paonta Sahib 2008
|
| Dewas site 2008
| Ohm Gloversville 2009
|
| Mohali site 2008
| Mohali site 2008
质量体系
- 放行前审核偏差、OOS、调查
- 调查未扩大至对其他批次产品和其他品种的影响
- FAR报告不及时
生产和加工
| 设施设备
实验室控制
物料系统
|
|
重点来看2009年针对Paonta Sahib场地AIP、2012年对Paonta Sahib、Dewas场地CD的理由,以及2012年和2014年Peter E. Baker检查Tonasa时发现的缺陷。
| 2009年Paonta Sahib场地的AIP
背景
- 2006年、2008年,对该场地分别进行了两次现场检查;
- 第一次,2006年2月20日-25日现场检查;3月20日、4月20日、5月25日企业分别回复483;6月15日仍发警告信。
- 第二次,2008年3月3日-7日现场检查;5月1日企业回复483(包括由于2006年7月、8月生产的申报批设备清洁、批生产和检验记录存在缺陷而撤回相应的ANDA申请);9月16日发警告信。5月12日,FDA发信给Ranbaxy,指出由于有相同的生产管理与质量管理部门,Batamandi应为Paonta Sahib场地的一部分,因此本次检查发现的缺陷体现了上次检查后Paonta Sahib场地质量体系的缺陷仍继续存在。
AIP内容
在AIP中,指出与两次现场检查发现的质量体系缺陷相关的,影响ANDA申请的问题,包括:
1. 稳定性研究用样品贮存和检验的关键信息缺失。
2. 2006年8月26日,回复2006年现场检查警告信时,同时修改之前氟康唑片(Fluconazole Tablets)和 (环丙沙星片Ciprofloxacin Tablets) ANDAs的稳定性数据。稳定性研究实际检验日期甚至会晚于申请中日期几个月,还出现回复警告信时日期正确,ANDA年报中日期继续错误。
3-6. 2007年7月27日,FDA OMPQ与Ranbaxy 法律顾问交流“稳定性研究确认报告(简称确认报告,the stability verification report)",提交的这些稳定性虚假信息是FDA审评申请的重要信息。包括:
- (1)申报批样品保存在冰箱中,没有相应方案、规程和记录,暂存时间只能估算(239批+67批的多数来自申报批,冰箱中暂存2天至201天),由于提交给FDA的稳定性研究方案和数据未描述冰箱中的样品,因此被认为造假。具体为:对冰箱中暂存样品的稳定性数据进行确认,发现大量偏差:对239个样品中的129个进行分析(剩余样品已停止稳定性研究),对应171份稳定性研究报告,各时间间隔的检验结果均符合预设的质量标准;全部129个样品/171份报告的稳定性研究报告日期均需要更正,其中13份中期报告中对样品的暂存日期估计有误,122份报告值从原始数据誊写错误,1份报告包装类型不正确。
- (2)用于申请中ANDA的稳定性数据,2257处检验日期错误,1385处检验结果错误(修改为符合质量标准限度);15份已批准ANDA的稳定性数据,1676处错误,包括检验日期、检验结果、包装。
- (3)稳定性研究的实际检验日期比申请或年报中日期晚数周或数月。3,6,9月的数据,实际检验日期是同一天或相差没几天。在本“确认报告”之后,Ohm辛伐他汀片(ANDA 76-285)年报中的稳定性数据,仍存在检验日期和检验结果不一致。
7. 2008年3月的PAI检查,在批记录中发现,ANDA申请中批记录中日期有当天不在现场员工的操作或确认签名。
以上行为,表明提供虚假的实质性信息已成为常规和行为模式,因此FDA有理由怀疑包含该场地数据和信息全部申请的可信性。根据AIP政策,FDA会对其进行评估,该评估将持续进行,不仅作为审评过程的一部分,而且在数据可靠性问题解决之前,不会对科学数据进行实质性审评。即自AIP日起,对来自该场地的全部原始申请、补充申请、增补(包括审评中或新提交的),在评估其可信性之前,不会进行常规的科学审评(CMC、标签等),除非该申请明确关乎到公众健康。
AIP政策参考《实质信息的虚假、不真实陈述,贿赂及非法酬金》,
FDA如何实施可信性评估参考《内部审评和纠正措施实施计划的考虑要点》
如果企业想与FDA讨论解决数据可靠性和可信性问题, 需安排与CDER OMPQ办公室主任会谈。如无意解决,需在10日就附件列出的Paonta Sahib场地的ANDA申请通知FDA是否同意该清单已经拟采取的行动。
|
| 2012年对Ranbaxy Paonta Sahib、Dewas场地永久禁令的合意判决
发现的问题包括,未能保存表明药品正确生产的书面记录;未能调查表明药品不符合其质量标准的证据;未能充分隔离青霉素类和非青霉素类生产设施以防止交叉污染;没有防止无菌药品污染的充分措施;对药品检验不充分无法确保在到期日前仍保有其效力和效果等。
认定Ranbaxy向FDA提交虚假信息,包括倒填检验日期,提交检验样品不存在的检验数据等。
在FDA对包含来自Paonta Sahib, Dewas场地数据或其他信息的申请进行审评前,要求Ranbaxy首先符合详细的数据可靠性条款。
具体地,Ranbaxy必须:
(1)聘用第3方专家对上述场地实施彻底的内审, 并对包含来自上述场地数据的申请进行审计。
(2)实施能够充分确保企业申请数据可靠性的措施和控制手段。
(3)撤回包含实质性虚假陈述,或包含影响审评批准的数据异常行为/模式的申请。
该CD阻止Ranbaxy在Paonta Sahib、Dewas、 Gloversville场地生产的药品进入美国市场和用于PEPFAR项目,直至其符合美国药品生产质量标准为止。
根据该CD协议,一旦Ranbaxy满足数据可靠性要求,应由第3方专家对上述场地实施审计确认其合规性。
企业必须授权确定的个人负责全部质量保证和质量控制的活动以确保药品具有要求的安全、鉴别、效力、品质、纯度、含量,符合法律和该CD。
企业必须建立数据可信性办公室,对来自进入该CD场地的申请在提交前进行审核。
Ranbaxy同意放弃3个申请中的ANDA可能的180天专营期,同意如果在给定的日期内仍不能满足特定的CD要求,放弃另外一些申请的180天专营期。
该CD包含违约金规定。
该CD允许FDA在现场检查中发现场地活动不合规或者有严重的数据可靠性问题时令其他的Ranbaxy场地进入该CD。
|
Peter E. Baker检查Tonasa时发现的缺陷
2012年
1. 偏差调查不充分
2. 生产记录不完全准确,不是由操作人员记录
3. 设备维护保养方案有缺陷
4. 取样计划和规程不科学可靠,不能确保原始物料和原料药符合确立的质量和纯度标准
5. 非药典方法未经验证
6. QC实验室的计算机化系统未建立适当的控制
- 顶空进样气相色谱未建立充分控制以防止未经授权的访问、修改、清除数据文件和文件夹。两台气相的工作站均有不设置密码的账号,具有管理员权限,登录后可以删除原始数据文件。
- 气相的计算机化系统设计为多人有管理员权限,缺乏合理依据,例如有些人仅是审核和批准分析数据。管理员权限可以删除原始数据文件和文件夹。
7. 留样保存方案有缺陷
8. 偏离分析方法的偏差未论证
| 2014年
1. OOT未报告
2. 未按规程检验样品
3. 计算机化系统控制不充分
- 缺陷重复出现。
- 气相的独立计算机化系统缺乏充分控制来防止未经授权使用、修改、删除数据文件和文件夹。检查工作站的审计追踪时发现,标准品和样品进样的原始数据文件可被删除,从而清除检验的证据,表现为该工作站的数据文档中缺少原始数据文件。例如,检查2011年1月的审计追踪,发现至少一针与某批次残留溶剂OOS调查有关的进样没有保留。检查2013年8月的审计追踪发现某批次溶剂残留检验的进样没有保留。
4. 记录不及时
5. 实验室样品保存不当无法防止混淆
6. 检测设备不充分
7. 设备维护记录不完整
8. 检测设备校正、确认、维护不当
|
可以发现Ranbaxy同时存在注册诚信和数据可靠性两类问题,主要表现在,稳定性研究数据不真实,文件记录不完整、不及时,实验室数据操控、无审计追踪。
影响1:2013年财年,美国各子公司业绩全面下滑
Ranbaxy Pharmaceutical Inc USA(RPI),2014年1月11日,禁止来自Toansa场地的API出口到美国,Ranbaxy公司及各子公司无法使用来自该场地的API,截止2014年3月31日,RPI公司还有来自Toansa场地价值1210万美元的存货。
Ohm Laboratories Inc USA(Ohm),季度销售额比平均值低40%,比2013年同期下滑34%,主要是因为缺少来自Toansa场地的关键API。OTC产品销售下降12%,其中8%受Toansa场地影响。还有来自Toansa场地价值1014万美元的存货。
Ranbaxy Laboratories Inc USA(RLL),2013年5月13日就民事和刑事指控与美国司法部达成协议,赔偿与罚款总额计5亿美元(已于2011年12月31日披露该金额),RLL公司承担2.61亿美元,其美国子公司承担3.4亿美元。
|
影响2:埃索美拉唑镁肠溶胶囊(ANDA 077830) 和盐酸缬更昔洛韦片(ANDA 078078)的美国首仿被撤销
2014年5月,竞争对手以数据造假为由对FDA提交公民请愿,请求将Ranbaxy的某些暂时批准的首仿品种试用“注册诚信政策”,取消180天专营期。
2014年11月,FDA撤销之前授予的埃索美拉唑镁肠溶胶囊(ANDA 077830) 和盐酸缬更昔洛韦片(ANDA 078078)暂时批准,确定Ranbaxy丧失盐酸缬更昔洛韦片的180天专营期。
2014年11月,Ranbaxy诉FDA,Ranbaxy就FDA取消Nexium首仿和Valcyte首仿的180天专营期,批准竞争对手仿制药对手上市,向哥伦比亚地区法院提起诉讼。
|
备注1:合意判决,即Consent Decree,是FDA能够采取的最为严厉的监管措施,也是制药企业尽力避免的情形。一旦达成“合意判决”,解除该“判决”,往往需要数十年的时间。比如2015年Pharmlot报道Abbott Lab始于2002年的合意判决,终获解除。
备注2:进口禁令,编号:进口禁令66-40,黑名单(the Red List)66-40,名称:“对于不符合药品GMPs的企业出口到美国的药品,无需物理检查即可扣留”;原因:FDA现场检查发现某场地的运行不符合cGMP的要求;指控:基于FDCA的第801(a)(3)款,该货物被拒绝进入美国,因其生产中所使用的方法和控制、对药品的控制不符合第501(a)(2)(B)款含义下的cGMP要求。
编译:识林-榛
识林TMwww.shilinx.com版权所有,未经许可不得转载。如需使用请联系admin@shilinx.com
|