
|
FDA 检查监督弹性路线图,疫情下检查延期致 48 件...
2021.05.07
美国 FDA 于 5 月 5 日发布《FDA 检查监督弹性路线图》,介绍了检查积压的增长以及对批准和合规性后续措施的影响,并给出了三种不同情形下的检查进展预期。
FDA 在报告中指出,由于疫情期间难以检查或评价生产设施,而导致有关人用药的 48 件审评决定被推迟,其中包括 6 件...
|

|
众监管机构讨论远程虚拟检查的期望和挑战,迫切希望回...
2021.05.01
美国 FDA 和欧洲药品管理局(EMA)的监管者们于 4 月 28 日在 ISPE 全球制药监管峰会上提供了有关桌面检查和虚拟检查的最新信息,并就如何确保更顺畅的检查提供了建议。
尽管监管机构似乎已经接受了在疫情期间执行虚拟检查和桌面检查的现实,但会上大量监管官员表示,现场检查更容...
|

|
FDA飞速检查新冠疫苗CMO并发布长达12页的483
2021.04.22
美国 FDA 于 4 月 21 日(周三)公布了其对 Emergent Bio Solution 巴尔的摩工厂的检查 483,总共 12 页,9 大观察项。
此次 FDA 行动速度之迅速,自上个月底 Emergent 被曝出在生产强生和阿斯利康的新冠疫苗可能存在交叉污染问题,强生将此情况报告给了 FDA。【CMO混淆...
|

|
FDA 制药设施远程交互评估指南解读:未来或有更多检...
2021.04.17
美国 FDA 于 4 月 15 日发布了疫情期间对药品生产和生物研究监测设施进行远程交互评估的指南,介绍了 FDA 可能使用的远程交互工具。指南发布当天识林就详细介绍了指南内容,参见【千呼万唤始出来:FDA 发布制药设施监督远程交互评估指南】。今天我们来看看美国霍金路伟(Hogan Love...
|

|
FDA 基于远程文件记录审查已发布四封 GMP 警告信
2021.04.15
美国 FDA 于 4 月 13 日公布了针对南美洲哥伦比亚原料药(API)制药商 Proquimes SA Productos Quimicos Especializados SA 的 GMP 警告信。该警告信与 FDA 自年初以来发布的其它三封警告信一样,基于的仅是记录审查而非现场检查。
这些警告信表明在新冠疫情期间,由...
|

|
千呼万唤始出来:FDA 发布制药设施监督远程交互评估...
2021.04.15
美国 FDA 于 4 月 14 日发布了有关新冠期间对制药设施进行监督的远程交互评估的指南,介绍了各种交互式和虚拟工具。FDA 将其对这些交互工具的任何组合的使用称为远程交互评估。
指南题目为“在 COVID-19 公共卫生紧急事件期间,对药品生产和生物研究监测设施进行远程交互评估(Remote...
|

|
FDA 被举报检查结果不当降级,默沙东疫苗工厂存在严...
2021.04.02
一名前美国 FDA 检查员举报 FDA 对一系列制药商的违规行为从轻处罚,其中涉及位于北卡罗来纳州 Durham 市的默沙东公司疫苗工厂。
在调查了举报人的指控后,特别检察官办公室(OSC)在周三给美国总统拜登的信中详细说明了这些指控。尽管举报人对 FDA 在几家工厂的违规行为表示担...
|

|
英国 MHRA 提供有关恢复现场检查的详细指南
2021.03.22
英国药品与医疗保健产品监管机构(MHRA)于上周发布指南表示将于 3 月 29 日开始恢复基于风险的现场检查,同时将继续执行远程检查。【英国 MHRA 远程药品 GMP 检查经验 2020/07/18】
MHRA 表示将与业界合作,以在可能的情况下减轻 COVID-19 大流行期间的监管负担,包括...
|

|
FDA 探索疫情期间检查替代方法以及疫后检查策略
2021.03.20
美国 FDA 代理局长 Janet Woodcock 和监管事务副局长 Judy McMeekin 于 3 月 18 日发表官方博客文章表示,正在研究工厂直播视频等检查替代方法,同时在为现场检查恢复后如何解决积压问题做准备。
Woodcock 和 McMeekin 表示,“我们将继续研究如何合并其它数据集和洞察...
|

|
FDA 通过预测分析工具监控疫情期间工厂质量风险?
2021.03.12
美国 FDA 表示,当检查员无法开展常规监督检查时,药品质量办公室(OPQ)下的质量监督办公室(OQS)将更多地依赖于预测分析来评估疫情期间的药品质量。
OQS 代理主任 Jennifer Maguire 在 3 月 1 日的国际过程分析与控制技术(IFPAC)会议上表示,该工具被证明从不断增加的场...
|

|
FDA 检查问题再次被摆上听证会桌面,新老问题齐发
2021.03.08
美国政府问责办公室(GAO)官员表示,FDA 需要确保由于新冠(COVID-19)旅行限制导致的逾期监督检查积压数量不会损害其未来执行“高风险”检查的能力。
GAO 医疗卫生小组主管 Mary Denigan-Macauley 在 3 月 4 日提交的关于 FDA 检查的听证会的书面证词中表示,FDA 还应...
|

|
请来厂里检查吧?FDA:等等再说
2021.03.03
美国 FDA 的现场检查工作随着新冠(COVID-19)疫情的持续仍处于不确定状态。药品申办人急于想了解如何才能向 FDA 保证其场地可以安全地进行检查,以期让已经延迟的产品批准尽快走向正轨。
一种想法是制定详细的现场检查接待计划。Hyman, Phelps and McNamara 律所律师 Douglas Fa...
|

|
美国 FDA 检查分类情况回顾,做好准备迎接未来的检...
2021.02.12
识林祝大家过年好!牛年第一天我们来回顾一下 FDA 2020 财年的检查分类情况,以及通过这些数据,企业可以提前为未来的检查做哪些准备。
去年,疫情严重影响了美国 FDA 的执法计划,这一影响将在今年持续,并可能波及未来几年。上周识林集中报道了有关 FDA 首封基于远程记录审查的警...
|
|
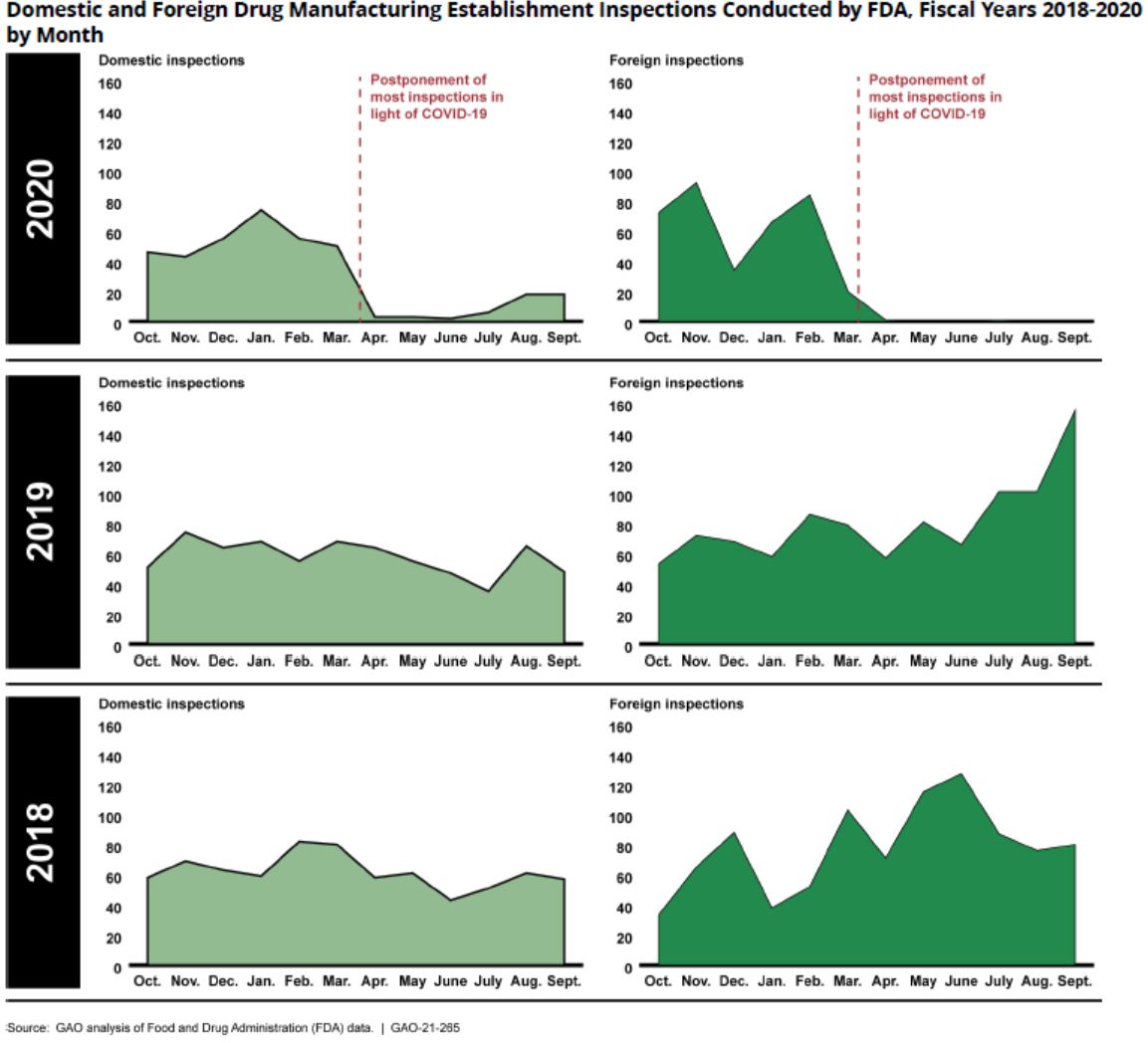
美国政府报告呼吁 FDA 考虑检查替代方法解决积压,...
2021.02.05
美国政府问责办公室(GAO)于 1 月 28 日发布了一份题为《COVID-19:关键疫苗分配,供应链,项目完整性,以及其它需要联邦政府重点关注的挑战》的近 350 页的报告(报告全文和治疗产品、医护用品供应链、卫生保健指标数据收集、药品生产检查、联邦合同、工人安全和健康监督、对渔业...
|

|
法律专家对 FDA 首封远程记录审查警告信的解析和建...
2021.02.03
2021 年 1 月 22 日,美国 FDA 向宁波余姚市益佳日化公司签发了一封警告信,警告信是 FDA “根据《联邦食品、药品和化妆品法案》(FDCA)第 704(a)(4) 条的规定在 2020 年 3 月 31 日提出了记录和其它信息要求,FDA 审查了益佳日化回复提交的记录”而发出的。这似乎...
|

|
欧盟检查员分享远程 GMP 检查经验,或将成永久性措...
2021.02.03
在正在进行的试点取得早期积极成果之后,欧洲药品质量管理局(EDQM)计划将“实时远程检查”作为其 GMP 检查计划的一项永久性措施。
这项试点是由于与 COVID-19 相关的旅行限制导致的现场检查的推迟而启动的。到目前为止,EDQM 的检查员已经从他们在欧洲的办公桌旁对印度两家制药...
|

|
Recent FDA Warning Letter Highlights Potential R...
2021.02.03
On January 22, 2021, FDA issued a Warning Letter to Yuyao YiJia Daily Chemical Co., Ltd., an over-the-counter drug manufacturer located in Ningbo, China. The Warning Letter was issued based on FDA’s review of “the records Yuyao submitted in resp...
|

|
PICS 与包装相关的 GMP 检查备忘录(附问题清单翻...
2021.01.22
国际药品认证合作组织(PIC/S)于 1 月 19 日连发四篇检查相关备忘录更新,昨日我们介绍了生物技术制品检查备忘录,并提供了有关具体生物技术检查问题清单的中文翻译,详见【PICS 生物技术制品检查备忘录更新】。
今天我们来看看另一篇检查备忘录:《PI 028-2 与包装相关的 GM...
|

|
PICS 生物技术制品检查备忘录更新
2021.01.21
国际药品认证合作组织(PIC/S)于 1 月 19 日连发四篇检查相关备忘录更新,包括:
PI 009-4 公共设施检查备忘录
PI 024-3 生物技术制品检查备忘录
PI 028-2 与包装相关的 GMP 检查备忘录
PI 038-2 质量风险管理(QRM)实施的评估备忘录
此次修订主要是更新了对 PIC/S ...
|

|
FDA 现场检查替代计划进展缓慢导致关键新药审批停滞
2020.12.14
新冠疫情爆发已经近一年,由于旅行限制和边界关闭等因素,药品监管所必须的现场检查工作难以开展,许多疫情高发的国家和地区先后提出替代现场检查的办法,但是美国 FDA 到现在为止还没有实质性的改变,而这已经影响到一些患者急需的挽救生命药物的短缺问题。
前 FDA 合规和生物制品...
|