
|
老问题新热度:FDA 再次因海外检查不力饱受批评
2020.06.04
国外检查提前通知,依赖企业方提供翻译,大流行期间停止国外检查的影响等。
美国 FDA 再次因其在国外药品生产设施检查方面的问题受到国会和美国政府问责办公室(GAO)的诘难。问题都不是新问题,有些问题甚至已经被提了有十年之久,但是在新型冠状疾病(COVID-19)大流行以及国际大...
|

|
英国 MHRA 2018 GMP 检查缺陷趋势分析:数据总览
2020.05.26
英国药品与医疗保健产品监管机构(MHRA)于 2019 年 10 月发布了其在 2018 年的 GMP 检查缺陷,与前几年不同,2018 年 GMP 检查缺陷数据采用了电子表格的形式,公布了 6200 多行数据,人们可以根据自己的需要进行解析和呈现数据。而此前的 2015 年,MHRA 均是提供的约 10...
|

|
印度药企呼吁 FDA 在疫情期间执行虚拟现场检查
2020.05.06
作为全球最大的药品出口国之一的印度正受到新型冠状病毒疫情的沉重打击,原因是全球旅行限制使得药厂日常运行复杂化,其中一个原因就是,FDA 对国外检查已暂停将近两个月,并且没有丝毫的恢复迹象。印度药企正在努力寻找解决方案,希望 FDA 在疫情期间对生产场地执行虚拟检查。
根据...
|

|
FDA 检查冻结合规判定或加速,疫情下企业纠正措施难...
2020.04.10
新型冠状病毒疾病(COVID-19)大流行,可能会导致美国 FDA 加快对之前已检查设施的合规行动,因为检查员不再出现场,他们或有更多时间来完成对以前检查的设施评估。但,检查冻结可能会使制药商在拿到不利检查结果后试图使工厂重新达到合规状态更加困难,并且可能会延迟 FDA 对检查设...
|

|
FDA 2019财年警告信趋势:继续加强对供应链和非处方...
2020.03.18
昨日我们回顾了 2019 财年 FDA 的药品 GMP 警告信,概述了 2019 财年的数据以及 2013 财年以来的警告信趋势。今天我们更深入地来看看收到警告信的制药商类型,包括非处方药(OTC)制药商和顺势疗法制药商,人细胞疗法制造商,与血管紧张素 II 受体阻滞剂(ARB)的亚硝胺污染相...
|

|
FDA 2019 财年警告信趋势分析:美国境内警告信大增...
2020.03.17
美国 FDA 2019 财年发布的警告信在主题的多样性、重点以及执法行动趋势方面都值得好好分析。本文提供了 2019 财年发布的药品警告信的综合摘要,包括对 2013 财年以来的警告信趋势评估。文中 2019 财年的数据基于 FDA 于 2020 年 1 月 20 日之前公布的药品 GMP 警告信。...
|

|
WHO 宣布全球大流行,FDA 暂停境外检查和外部会议
2020.03.12
当地时间 3 月 11 日晚,WHO 总干事谭德塞宣布新型冠状病毒肺炎(COVID-19)疫情为全球大流行(pandemic),并表示情况将进一步恶化。谭德塞表示,“宣布大流行并不会改变 WHO 目前针对新冠肺炎疫情的评估和正在开展的工作。”
WHO 紧急卫生计划负责人 Mike Ryan 在本周一...
|

|
FDA 疫情应对行动:关注供应链和在中国的检查工作
2020.02.19
美国 FDA 于 2 月 14 日发布公告介绍 FDA 在应对新型冠状病毒疾病(COVID-19)方面的行动,强调工作重点是积极促进诊断、治疗和预防;监督医药产品供应链中是否存在潜在短缺或中断,并在必要时帮助减轻相应影响;充分利用公共卫生工具保证医药产品安全和质量。
FDA 局长于 2...
|
|
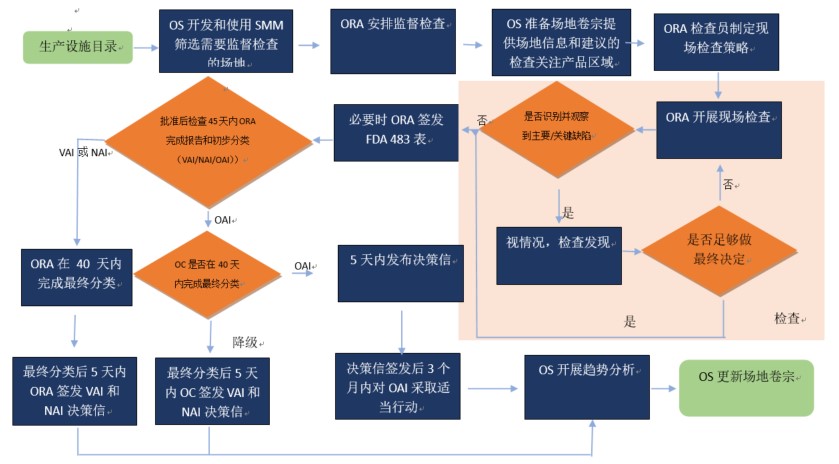
GMP 检查结束到最终合规判定的 90 天发生了什么?
2020.01.22
遇到过几家企业,检查结束后感觉不错,也没感觉FDA检查员说什么严重的,但最后结果是OAI(Official Action Indicated, 官方行动指示,即检查不通过),甚至还吃了警告信,那么检查之后FDA内部是怎样的流程呢?
FDA 90天合规判定的绩效逐步实现
根据GDUFA II,FDA承诺在检查结束...
|

|
中国和PICS的2020工作计划
2020.01.15
2020年1月1日,PIC/S迎来了第53个成员机构,意大利兽医药局(Italian Veterinary Agency, DGSAF)。另外巴西已经接近了PIC/S评估程序的尾声,而俄罗斯已经完成了预评估程序。被选任2020-2021年PIC/S主席的Anne Hayes在去年12月30日的发布会上,谈到了2020年PIC/S的计划和优先级。Ha...
|

|
2019 年中国企业不合格 483(OAI)细读
2020.01.14
注:在研究过程中,我们发现FDA提供的清单存在显著缺失,不少识林483数据库中已经收录的483并没有在其中体现,FDA对此备注说:并非所有的检查都收录在数据库里,不包括州检查、批准前检查、专论设施检查、等待最终执法行动的检查和非临床实验室检查。如果大家还发现有其它类型的缺失信息,...
|

|
【周末杂谈】OAI、透明公开监管与产业发展
2020.01.12
上月11日,在美国食品药品法研究所在华盛顿举行的一次会议上,FDA药品审评和研究中心合规办公室(Office of Compliance,OC)主任D. Ashley高兴地报告,2019财年(9月30日截至),在GMP检查后90天(本文引用的都是自然天,不是工作日)内,OC完成了86%的检查结果分类,比2018财年增加...
|

|
零483代表什么 – 透过数据看合规
2020.01.07
注:在研究过程中,我们发现FDA提供的清单存在显著缺失,不少识林483数据库中已经收录的483并没有在其中体现,FDA对此备注说:并非所有的检查都收录在数据库里,不包括州检查、批准前检查、专论设施检查、等待最终执法行动的检查和非临床实验室检查。如果大家还发现有其它类型的缺失信息,...
|

|
国际检查互认不断拓展,菲律宾加入东盟互认协议
2020.01.02
国际检查合作和互认已是大势所趋,下一步的工作是在深度和广度上的进一步扩展。过去识林多次报道了美国、欧盟、加拿大、英国、澳大利亚、日本之间的合作和互认,今天识林带你来看看我们的邻居 — 东盟,在检查互认方面的工作。
在经过一长段时间包括文件、现场、过程中检查评估的审...
|

|
FDA 副局长谈美欧药品检查互认协议的影响
2020.01.02
美国 FDA 全球政策与战略副局长 Mark Abdoo 最近在 FDA 《全球视角》栏目中谈到了自美国/欧盟互认协议(MRA)实施以来一些影响性数据,并承认 MRA 还需要收集更多数据,纳入更多衡量指标,从而帮助 FDA 分配资源并扩展 MRA 的范围和广度。
当我们首次开始与欧盟讨论互...
|

|
欧盟拟加强原料药安全性监督,重点关注中国和印度
2019.12.26
上周我们刚刚在【无菌药品检查国际合作试点启动,中国和印度或将面临更严检查】中预测了检查国际合作可能会让参与国家将更多检查资源集中在中国和印度,现在欧盟的另一份文件就挑明了这一问题。欧盟委员会认为最近涉及到从中国和印度进口的原料药(API)污染问题(缬沙坦和雷尼替丁中的亚...
|
|
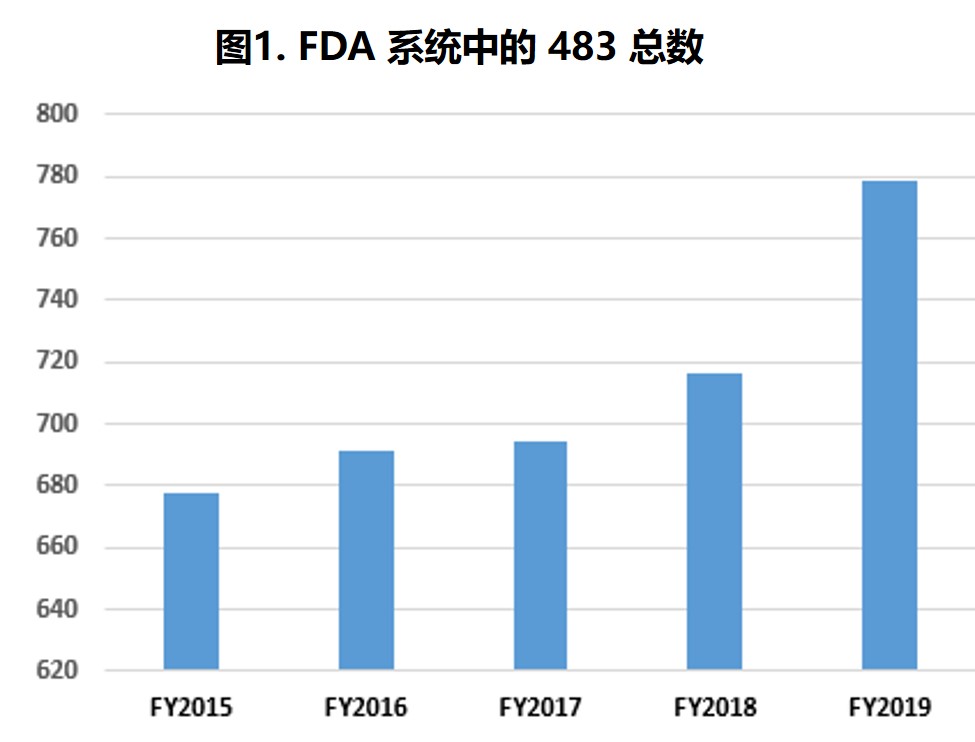
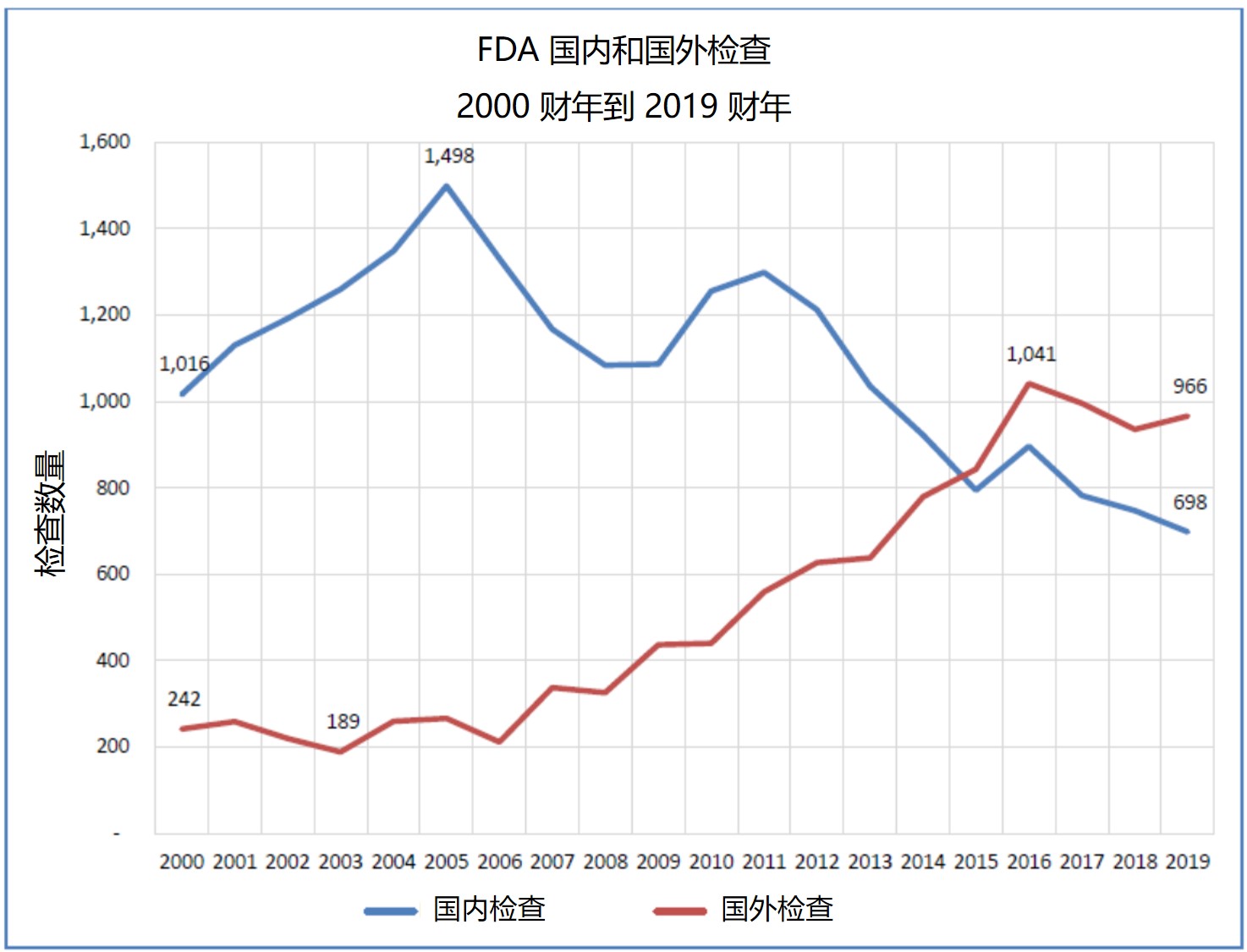
FDA 2019 财年药品检查观察项和趋势
2019.12.19
过去五个财年中,分析中所包含的 483 数量每年都略有增加,检查次数在 645 到 779 次之间(表1第2行和图1)。
自 2013 财年以来,指证 §211.192(偏差调查)失败的观察项在 2018 财年首次从名单魁首的位置上移下来。
2018 财年,§211.160(b)(实验室控制应包括科学合...
|

|
无菌药品检查国际合作试点启动,中国和印度或将面临更...
2019.12.19
欧洲药品管理局(EMA)于 12 月 17 日宣布启动一项为期两年的无菌药品 GMP 检查国际合作试点计划,该计划可以使包括欧盟、美国、英国、澳大利亚、加拿大、日本等国在内的监管机构共享无菌药品生产场地的 GMP 检查信息。参与机构由此而节约的检查资源或将更多的集中在高风险场地和...
|
|
FDA 药品中心主任表示国外检查需要更多检查员和翻译...
2019.12.12
美国 FDA 药品审评与研究中心(CDER)主任在 12 月 10 日举行的众议院能源与商业监督小组委员会关于“保护美国药品供应链:监督 FDA 国外检查计划”听证会上表示,如果国会批准,FDA 可以使用更多资源执行更多国外检查。听证会上,Woodcock还为有关 FDA 严重依赖国外提前通知的...
|

|
识林助力海南药业国际化
2019.11.09
2019年11月7日,海南省医药行业协会、和识林联合举办“海南医药行业国际化认证标准培训”, 200余名药企代表参加了会议。
海南省医药行业协会会长陈益智、副会长李伟、秘书长鲁红出席会议,培训开班仪式由海南省医药行业协会轮值常务副会长仲盛祥主持,培训会由海南省药品监督管理局药...
|