
|
2026 UCSF-Stanford 监管科学创新峰会
2026.01.14
1月11日,美国加州大学旧金山分校(UCSF)和斯坦福大学联合举办了“2026监管科学创新峰会”。这是学界-政府-商界高端年度交流会,氛围轻松、求真、开诚布公,无商业气息。每年开在JP Morgan健康医疗大会的前一天,同在旧金山。
峰会
今年峰会不如去年“峰”。FDA近来变化剧烈,官员...
|

|
实时公布 CRL 后,FDA 可能考虑披露更详细的“行动...
2026.01.14
1月11日,FDA新药办公室(OND)主任Mary Thanh Hai在旧金山举行的“2026监管科学创新峰会”上表示,披露未批准药品的完全回应函(Complete Response Letter, CRL)是否有助于创新,“时间将给出答案”。但她同时指出,由于已知自己撰写的内容将被披露,审评人员需要慎重考量如何撰写...
|

|
FDA 为 CGT 提供灵活性,重申 cGMP、质量标准和验...
2026.01.13
FDA于2026年1月11日发布公告,宣布CBER在监管细胞与基因治疗产品(CGT)的化学、生产与控制(CMC)方面采取灵活性策略。
这些策略得到领导层高调背书。FDA局长Marty Makary表示:“监管灵活性必须为CGT量身定制。这些是切合实际的改革,旨在应对CGT的独特特性,并促进更多创新。”CBE...
|

|
裁员暂未干扰2025新药批准,FDA 新招450人
2026.01.13
FDA局长Marty Makary终于在填补该机构人员空缺方面取得进展。根据Pink Sheet报道,Makary在一段面向员工的视频中表示,目前有450名新员工正在入职流程中,其中40人已经开始工作。
尽管FDA未明确新员工具体岗位安排,但可供参考的是此前美政府于2025年10月停摆时,有报道称FDA在政府...
|

|
国际药政每周概要:2026年 FDA 的 CGT 指南计划,RM...
2026.01.13
【非临床与临床研究】
1.7,【PMDA】IgA 肾病药物疗效评估需考虑的要点(早期考虑)
1.9,【FDA】指南议程:CBER 计划在2026日历年发布的指南文件
【药学研究】
1.7,【EDQM】欧洲药典12.3现已发布
【注册审评与变更】
1.8,【FDA】MAPP 5017.8 Rev. 1 ...
|

|
ECA 调研无菌制剂目检,人工仍主流,AI 可期
2026.01.12
2025年9月至10月期间,欧洲合规学会(ECA)目检专家组对其成员单位开展了一项关于无菌制剂产品100%目检当前行业实践与合规性的调研。调研报告于近日发布。
调研结果显示,行业实践基本符合《EU GMP无菌附录1》(第8.30–8.33条)、美国药典(USP)和、欧洲药典(Ph. Eur.)2.9.2...
|

|
CGT 在2026年可能迎来的 FDA 指南
2026.01.12
1月9日,CBER发布了《指南议程:CBER 计划在2026日历年发布的指南文件》,罗列有望在2026年制定、修订或定稿的指南文件标题。
尽管单抗等生物制品已移交CDER,但CBER仍监管CGT,其指南计划有助于我国相关企业提前做好预案。但这份计划另一个值得关注的方面是,在特朗普所谓“十换一...
|

|
国内药政每周导读:药品受托监督落地,进口急需药品审...
2026.01.12
【CMC 药学研究】
1.5,【CDE】关于公开征求《化学仿制药参比制剂目录(第一百零二批)》(征求意见稿)意见的通知
【注册与变更】
1.7,【NMPA】关于进一步优化临床急需境外已上市药品审评审批有关事项的公告(2026年第3号)
1.9,【CDE】常见一般性技术问题解答 - 新增2...
|

|
【周末杂谈】美国生物安全法
2026.01.11
该法律覆盖面广,时间紧,直接和间接影响值得尽早关注
近来发生的一系列国际事件显示国际法和国际组织的作用已不明显,因为建立和维护国际秩序的主要力量已发生了变化。全球面临的已不仅是供应链脱钩的产业和经济问题,还包括疆界和资源主权的再划分问题。大形势趋紧的形势下,我国药业应...
|
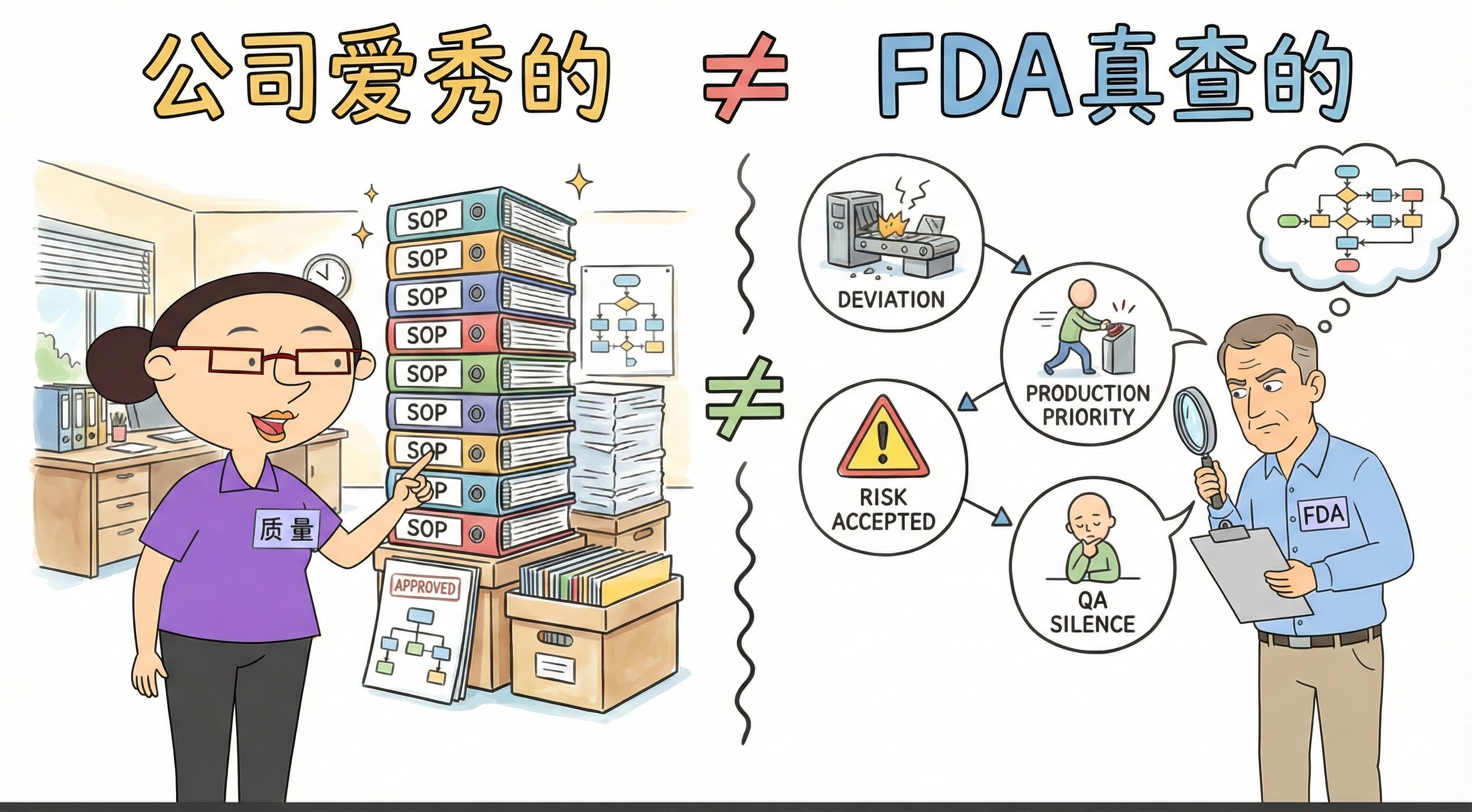
|
你以为 FDA 查的是...
2026.01.10
*以下内容编译自检查专家Ian Thrussell先生的分享,图片由Nano AI生成。
FDA查的不是文件,是决策。
公司爱秀的:
厚厚的SOP!
排版完美的记录!
“已批准”的流程!
FDA真查的:
为何容忍偏差?
为何生产优先?
为何接受风险?
为何质量沉默?
...
|

|
在附录22框架下,将“人在回路”AI 用于持续工艺确认
2026.01.09
近日,识林收录了一篇文献《制药行业持续工艺确认中的人在回路 AI 应用》。在制药业热切期待AI能在药物发现和临床试验领域发挥潜能之时,这篇文献聚焦于制造和GMP领域的AI应用,主题是在欧盟GMP《附录22人工智能》框架下,AI技术、持续工艺确认(Ongoing Process Verification, OP...
|

|
AI 已开始设计抗体药物,但“从头设计”尚待时日
2026.01.09
AI药物设计是近年来药物创新热点领域,在2026新年前后多家AI新药公司获得大药企和资本青睐之时,STAT发布了一篇题为《AI终于开始设计抗体药物,但何时才能革新生物医药产业?》(AI has finally started making drug-like antibodies. When will it revolutionize biopharm...
|
|
印度药监拟将止咳糖浆移出非处方药目录,应对严重污染...
2026.01.08
印度中央药品标准控制组织(CDSCO)于2025年12月29日发布一项修订草案,提议将止咳糖浆从《药品法规(1945)》附表K(Schedule K)中移除。该草案公示期为30天,面向公众征求意见。
根据现行法规,列入附表K的药品类别可在无处方情况下于零售渠道销售。附表K目前列有15类可豁免处方...
|

|
中国香港卫生署启动“1加”机制新药注册前“一对一”...
2026.01.08
近日,中国香港卫生署宣布正式启动针对“1+”机制新药注册申请的“一对一”会面咨询服务。该服务即日起接受申请,旨在通过前置咨询环节优化新药注册审批流程,进一步巩固香港作为国际医疗创新枢纽的地位。
卫生署推出的“一对一”会面咨询服务是“1+”新药注册申请前咨询服务体系的...
|

|
EMA 将通过指南落地哪些监管科学重点?
2026.01.07
2025年12月份,EMA发布了多个领域的监管工作三年滚动计划,包括非临床、方法学、生物制品、生物类似药、CHMP/CVMP(人用药/兽药审评)以及紧急工作组。计划的关键内容之一,也是业界可以直观感知到监管变革的,是其指南活动(Guidance activities)部分,即该领域正在和即将发布的指...
|

|
日本 PMDA 规划内部 AI 应用,先从运营提效起步
2026.01.07
12月8日,日本PMDA新建了“人工智能行动工作组”(AI Action WG)页面,并发布一份《PMDA 运营中 AI 应用的行动计划》,旨在系统性地导入人工智能(AI)技术,全面提升机构在药品和医疗器械领域的审查、安全监测及管理运营能力。
AI与药品监管的结合(点击阅读识林专题文章)可...
|

|
国际药政每周概要:新加坡 HSA 更新 GCP 检查等临...
2026.01.07
【非临床与临床研究】
1.2,【HSA】GCP 合规检查框架指南
【药物警戒】
12.31,【FDA】MAPP 6700.9 Rev.2 基于 FDA 不良事件报告系统的新安全信息或潜在严重风险信号的发布规定
【生产质量】
本周 483和警告信
【非临床与临床研究】
1.2,【HSA】G...
|

|
FDA 回顾加速罕见病治疗(ARC)框架下多个监管项目
2026.01.06
12月2日,FDA CDER发布了《加速罕见病治疗(ARC)计划-第三年年度报告》,系统回顾了ARC计划在2024-2025财年取得的进展。
社会发展与民众对罕见病的关注成正比。新的FDA领导层即使动荡不宁,但对于罕见病的关注和促进仍是一贯的,近期就推出“罕见病证据原则”和“合理机制路径”...
|
|
加拿大 HC 指导去中心化临床试验,监管重心是 QI
2026.01.06
加拿大卫生部(HC)在12月23日发布《关于去中心化临床试验的指南草案》,为申办者、研究者及相关各方提供技术与监管指引。
HC认识到去中心化研究更贴近参与者,有助于提升民众对试验及新疗法的可及性,并促进参与人群的多样性。原则上,HC对其监管要求与传统临床试验相同,但要求申办...
|

|
国内药政每周导读:新药管法实施条例过审,肿瘤药单臂...
2026.01.05
【早期研发与临床】
12.30,【CDE】关于发布《针对泛肿瘤的抗肿瘤药物临床研发技术指导原则》的通告(2025年第50号)
12.30,【CDE】关于发布《治疗慢性气道疾病的靶向炎症因子类生物制剂临床试验技术指导原则(试行)》的通告(2025年第51号)
12.30,【CDE】关于发布《艾...
|