
|
FDA 拟允许 MRD 和 CR 作为终点,加速多发性骨髓...
2026.02.04
1月20日,FDA发布《多发性骨髓瘤的微小残留病和完全缓解:作为支持加速批准的终点》指南草案。该指南聚焦于使用微小残留病(MRD)和完全缓解(CR)作为临床试验主要终点支持加速批准多发性骨髓瘤(MM)治疗药物的开发。
MM是全球第二大常见的血液系统恶性肿瘤。随着老龄化加剧及诊断...
|

|
国际药政每周概要:EMA 启动贝叶斯方法指南,共处理...
2026.02.04
【非临床与临床研究】
1.30,【EMA】关于修订诊断试剂的临床评价指南及其附录1成像试剂的概念性文件
1.30,【EMA】关于制定在临床研发中使用贝叶斯方法的思考性文件的概念性文件
【药学研究】
1.28,【EMA】关于固体口服剂型中使用的共处理辅料的问答(H&V)
本周BE...
|

|
EMA 2025 年否定性审评意见的药品申请
2026.02.03
2025 年,欧洲药品管理局(EMA)在集中审评程序中,对多项拟上市药物作出拒批或否定性意见,涉及儿科近视、慢性移植物抗宿主病、阿尔茨海默病、杜氏肌营养不良症、亨廷顿舞蹈症以及多种罕见肿瘤等高度关注领域。这些产品多数针对明确的未满足医疗需求,部分已在美国或中国获批上市,但...
|

|
临床数据可靠性问题触发 EMA 重审罕见病药 Tavneos
2026.02.03
1月30日,EMA的人用药品委员会(CHMP)宣布正式启动对Tavneos(通用名:avacopan)的审查。此次审查源于新出现的信息对支持该药物在欧盟获得上市许可的关键研究——Advocate试验——的数据可靠性提出了质疑。
Tavneos于2022年1月在欧盟获得批准,用于治疗患有严重活动性肉芽肿性多血管...
|

|
2026年 FDA 待批新药中的非标准审评重点品种
2026.02.02
据PinkSheet数据库显示,FDA在2026年伊始至少有56个新分子实体(NME)及新型生物制品处于审评阶段。这一数字较2023、2024及2025年均超过60个的待审数量略有下降。
药品审评与研究中心(CDER)承载近50个新药申请,数量与2025年初基本持平,而生物制品审评与研究中心(CBER)仅有8个新...
|

|
1-2个月审评后谁有权批准?批评质疑中 FDA 尝试澄清 ...
2026.02.02
1月13日的JP摩根会上,从CDER主任职位离职不久的Richard Pazdur公开批评了FDA内部的政治干预风险以及承诺1-2个月完成审评的“局长国家优先审评券”(CNPV)的透明度问题。FDA则在1月15日更新了一份“员工手册指南”,尝试澄清CNPV的认定和审评审批流程,但至关重要的批准决策权归属仍...
|

|
国内药政每周导读:新药管法实施条例落地,CDE 定稿...
2026.02.02
【非临床和临床研究】
1.27,【NMPA】关于适用《M14使用真实世界证据进行药品安全性评估的非干预性研究:规划、设计、分析和报告的一般原则》国际人用药品 注册技术协调会指导原则的公告(2026年第16号)
1.28,【CDE】关于发布《用于术后镇痛的长效局部麻醉药临床试验技术指导...
|

|
【周末杂谈】对 CGMP 中 C 和 GMP 的理解
2026.02.01
对C的一种内在的、无需与时俱进的理解
美国的药品GMP全称是CGMP,其中C代表Current,是当前、当今的意思。生产和质量管理的科学技术在不断进步,其监管应与时俱进,这是C的字意。言外之意,GMP本身不是与时俱进的。
其实,就连CGMP也称不上与时俱进。
FDA的CGMP自1978年发布后,已4...
|

|
【直播预告】2026年1月全球法规月报划重点
2026.01.31
识林2026年1月报直播如期而至,并同步推出1月报。本次直播聚焦1月全球主要监管机构的重点法规,并挑选影响力较大的文件做重点简介。短短40分钟,轻量而轻松,旨在帮助大家回顾上个月的监管重点,加深理解或是查缺补漏。
月报获取渠道:
会员:关注直播当日(2月6日,周五)的【最近更...
|

|
【课程与会议】近期更新的重点课程和2-3月会议预告
2026.01.31
近期更新重点课程
识林升级版用户,可在PC端和App、小程序移动端学习57个模块的1000+门课程7000+节视频,涉及药品研发、注册、生产、质量等全生命周期,包括IPEM项目部分精华课程摘要,监管和学术机构专题教学和研讨会,及供应商技术介绍专业课程。除视频内搜索、收藏、评论功能外,...
|

|
成立120周年之际,FDA 公布首个官方徽章
2026.01.30
1月28日,为纪念其成立120周年并重申机构职能,FDA正式揭晓首个官方机构徽章(Official Agency Seal)。该徽章的设计整合了多项历史与专业元素,体现了该机构在公共卫生领域的历史进展与未来目标。
Makary发文逐一介绍徽章中的元素和内涵:
徽章的边框的120个金色三角形:这些三角...
|
|
从2025看2026:生物类似药临床进一步简化,业界担忧“...
2026.01.30
2025年,全球生物类似药监管迎来转折性一年。从欧美(尤其是大步迈进的FDA)到日本加拿大再到ICH,多国和国际药监机构密集发布文件,共同指向一个核心趋势:在严格的分析可比性基础上,临床疗效比对研究(CES)正从“默认”转向“按需”。这一系列变革,为2026年生物类似药监管与市场发...
|

|
ICH 发新加坡会议纪要,更多指南议题进度公开
2026.01.29
ICH于2025年11月在新加坡召开了第51次ICH管理委员会(MC)及全体会议(Assembly)。相关会议的最终纪要于1月23日正式发布,总结了此次线下双年度会议期间所作出的各项决议与讨论要点。
此前识林曾报道新加坡会动态,特别是ICH启动撰写E23与M18。这次的纪要包含更多细节,尤其是新监管...
|
|
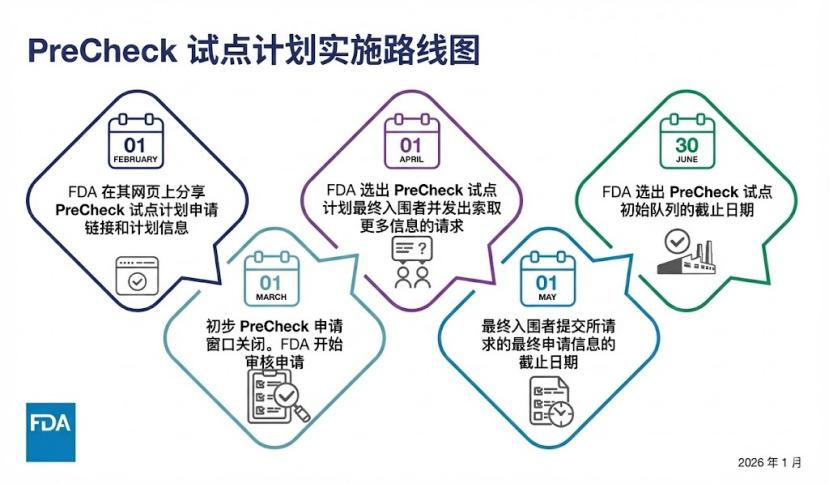
FDA 公布 PreCheck 路线图推动药厂“回流”
2026.01.29
FDA于1月21日发布实施路线图,确认将于2026年2月1日开始接受“预先确认”试点计划(PreCheck Pilot Program)的申请。
PreCheck试点计划将选择一批新的药品生产设施开始实施相关活动。设施的选择将基于其与国家优先事项的整体契合度,考量因素包括:拟生产的产品、设施建设阶段、为...
|

|
研究揭示远程试验成本不降反升,DCT 模式尚待优化
2026.01.27
近日,荷兰乌得勒支大学医学中心(UMC)的Aniek Schouten主导分析了欧盟RADIAL试验在临床研究中引入远程元素(也是主要的去中心化元素)的成本问题。该试验于2023年至2025年在六个欧洲国家开展,针对接受赛诺菲Toujeo(甘精胰岛素)治疗的2型糖尿病患者,设置了传统、混合与完全远程三...
|

|
2025年 EMA 批准38个新药,41个类似药,拒批7个,多...
2026.01.27
1月15日,EMA发布了《2025年的人用药》报告,列出了EMA全年出具的104份批准意见,包含38种新活性物质、16种孤儿药、4种先进治疗药品(ATMP)、41种生物类似药、10种仿制药,以及3款通过加速审评、6款通过PRIME计划、8款通过附条件批准及2款通过特殊情况批准等特殊途径上市的药品;同时包...
|

|
国际药政每周概要:FDA 新药审批年报,MRD 和 CR ...
2026.01.27
【非临床与临床研究】
1.20,【EMA】药物临床试验质量管理规范(GCP)检查员工作组(IWG)2024年度报告
1.20,【FDA】多发性骨髓瘤的微小残留病和完全缓解:作为支持加速批准的终点
【注册与变更】
1.23,【FDA】创新推进健康:2025年新药批准
【生产质量】
1.22,【...
|

|
【全文翻译】2025 年 FDA 新药审批总结报告
2026.01.26
美国 FDA 于 2025 年 1 月 26 日发布了其 2025 年度 FDA 新药审批总结报告。报告汇总了 FDA 药品审评与研究中心(CDER)去年一年中批准的所有新药、新用途和新使用人群以及生物类似药和可互换生物类似药、新配方和新剂型以及儿科人群扩展,概述了一系列值得注意的批准,提供了许...
|

|
FDA 研究解析替代终点,分享药物审批监管实践
2026.01.26
识林收录FDA研究人员近期发表的文章《监管决策中的替代终点》,系统阐述了FDA在药物审批中采用替代终点的监管框架与实践,对于相关药企评估替代终点开发策略较有参考价值。
FDA通过传统批准(TA)和加速批准(AA)两种路径审评药物。其中TA可依据临床终点或已验证的替代终点(SE)。...
|

|
国内药政每周导读:贝叶斯方法定稿,残留溶剂控制,局...
2026.01.26
【非临床和临床研究】
1.21,【CDE】关于发布《药物临床试验中应用贝叶斯外部信息借用方法的指导原则(试行)》的通告(2026年第6号)
1.23,【CDE】关于公开征求 ICH《E22:患者偏好研究的一般考虑》指导原则草案意见的通知
【CMC 药学研究】
1.22,【CDE】关于公开征...
|