|
BIMO 指南定稿,FDA 详述非临床和临床设施检查流程
2025.12.24
12月19日,FDA发布《适用于生物研究监测检查的流程和实践》定稿指南,旨在为接受FDA生物研究监测(Bioresearch Monitoring,BIMO)项目检查的设施提供关于检查流程、实践以及与FDA沟通的明确建议。
FDA的BIMO项目是一个综合性的监管项目组合。该项目旨在通过现场检查、调查以及远程...
|

|
前 FDA 检查副局长:以“检查准备度”应对“突击检...
2025.12.24
12月17日,前FDA主管检查的副局长、现任咨询公司Canal Row Advisors质量与合规部门负责人Michael Rogers在领英发表文章《FDA检查策略进化:两大变革形塑监管未来》(FDA's Evolving Inspection Strategy Two Shifts That Will Shape the Future of Regulatory Oversight)...
|

|
FDA 拟直接对接初创技术公司,合作开发 AI 等新技...
2025.12.23
12月19日,FDA发布了一份有些特别的信息请求(RFI),专门征求风险投资(Venture Capital,VC)机构的专业意见,旨在就建立一种新型合作模式强化FDA与美国最具创新力的初创技术公司之间的协作,以推动人工智能(AI)、生物技术、医疗器械及监管技术等领域的公共卫生创新。
FDA在公告...
|

|
FDA 与辉瑞合作综述当前 AI 在药物研发中的代表性...
2025.12.23
FDA CDER研究人员与辉瑞研发中心在11月联合发布了综述文章《人工智能在临床与转化科学中的应用:从实验室洞见到临床影响》,该文汇集了来自全球的30多篇研究论文,系统梳理了人工智能(AI)在药物研发全生命周期中的技术进展与实践案例。
当前各类AI相关新闻和文献众多,似乎其应用...
|

|
国际药政每周概要:FDA 生物制品立卷审查,BIMO 检...
2025.12.23
【早期开发与临床】
12.15,【FDA】增强临床试验参与 — 资格标准,入组实践和试验设计
12.15,【FDA】FDA 消除在药品和器械申请审评中使用真实世界证据的主要障碍
12.15,【FDA】医疗产品临床评价中的生物性别差异研究
12.16,【FDA】研究数据技术一致性指南 - 技术规范...
|

|
FDA 主动授予国家优先审评券,强生仍未签协议降药价
2025.12.22
FDA在12月15日的一份公告中宣称其基于一项III期临床试验的积极结果,主动向强生的teclistamab(特立妥单抗,商品名Tecvayli)联合daratumumab(达雷妥尤单抗,商品名Darzalex)用于治疗复发/难治性多发性骨髓瘤的疗法(Tec-Dara方案)授予了一张局长国家优先审评券(CNPV),有望将审...
|

|
2025年 AC 会骤降65%,哈佛研究质疑会议代表“一边...
2025.12.22
来自PinkSheet的最新统计结果显示,FDA在2025年全年仅举行11次专家咨询委员会会议(下称“AC会”),较2024年的31次和2023年的38次分别减少65%和71%。这数据甚至低于2020年新冠疫情高峰期,当时FDA通过线上形式举行了26次会议。
FDA对于AC会的质疑由来已久,局长Martin Makary...
|

|
国内药政每周导读:大量仿制药 BE 有望减负,Q12 ...
2025.12.22
【CMC 与仿制药】
12.15,【CDE】关于公开征求《化学仿制药滴眼剂研究技术指导原则(征求意见稿)》和《化学仿制药特殊滴眼剂研究技术指导原则(征求意见稿)》意见的通知
12.15,【CDE】关于公开征求《ICH M13A低风险制剂清单》(第一批)意见的通知
12.19,【CDE】关于...
|

|
【周末杂谈】质量对话 – 优秀的 GMP 检查员
2025.12.21
Ian Thrussell先生谈优秀的GMP检查员应具备的8项素质
【刺槐】 您心目中优秀的GMP检查员应具备哪些素质?
【专家】 首先应受到过良好的大学教育,例如,有药学本科或以上的学位,并有执业药师执照。
【刺槐】 您说的药学是pharmacy? 药师是pharmacist?
【专家】 是的。
【刺槐...
|

|
【新机构】识林收录新加坡 HSA 法规指南
2025.12.20
识林已正式收录新加坡卫生科学局(HSA)法规指南并将保持日常更新(会员点此进入机构页面),期待为稳步走向全球的我国制药业提供更为全面而及时的参考。
尽管人口仅有600万,作为国际金融中心和连接亚太与全球市场的战略枢纽,2023年新加坡GDP总量达到5014.3亿美元,人均GDP高达8....
|

|
2025财年 FDA 发布的483缺陷项统计梳理
2025.12.19
12月16日,FDA发布2025财年 483缺陷列表,识林已完成人工校对翻译,会员可查阅双语版本。
本文从两个维度对FDA 483缺陷项进行统计梳理。一是2013-2025财年FDA 483各类别缺陷项出现频次和比例;二是对FDA在2025财年(2024年10月1日至2025年9月30日)发布的483中所涉及的所有缺陷项按照...
|

|
研究文献严厉批评 FDA 海外药品检查系统性缺陷
2025.12.19
近日,一篇研究文献对FDA提出严厉批评,其标题有些耸人听闻《相信FDA对药品质量的保证可能危害患者健康》(Believing FDA's Assurance of Quality Pharmaceutical Products Can Be Dangerous to Your Patients' Health)。
两位来自康涅狄格大学的研究人员主要批评的是F...
|

|
PICS 和 EMA 拟修订2008年放射性药品 GMP
2025.12.18
EMA与PIC/S于12月15日发布概念性文件征求意见,启动修订现行2008年《GMP附录3:放射性药品生产》,以体现过去十七年间放射性药品法规、技术与生产环境的深刻变革。
这些变革包括欧盟法规、EMA放射性药品指南、GMP原则和相关GMP附录更新、ICH的新指南等等。此外,修订还将基于多年来PIC...
|
|
EMA 指导放射性药品 CMC 开发和申报资料撰写
2025.12.18
12月10日,EMA发布了《放射性药品质量指南》征求意见稿,为基于化学合成物质的放射性药品上市许可申请或上市后变更申请提供关于CMC药学开发和申报的特定要求。
EMA的这类“质量指南”通常都基于CTD质量模块目录来编排,直观地通过申报资料的章节阐述监管要求,同时回答“怎么做”以及...
|

|
FDA 下一变革是力推真实世界,局长再提中国竞争
2025.12.17
12月15日,FDA局长Marty Makary在纽约向华尔街听众表示,FDA将在药品和医疗器械的审评中更多地采纳真实世界数据(RWD),包括那些不包含可识别患者个体信息的大型数据集。
在同日发布的一份公告中,FDA宣布移除了对提交用于审评的真实世界证据(RWE)的一项关键限制:在针对某些医疗...
|

|
是利好也是压力,看欧美业界眼中的中国 IIT
2025.12.17
近日,美国颇具影响力的制药业媒体Endpoints发表了一篇专题文章,将目光投向中国的研究者发起的临床试验(IIT)模式。报道称这一模式以其成本低、周期短、审批流程灵活的特点,成为全球生物技术行业快速验证新疗法的重要途径。
据编者观察,美国媒体近年来越来越多提到中国创新药的迅...
|
|
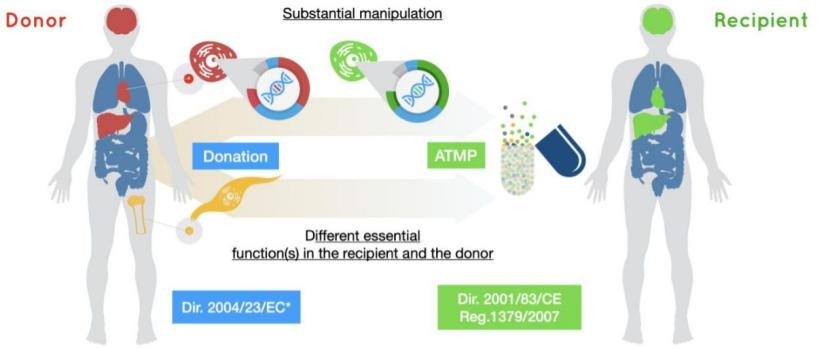
ICH 细胞基因疗法指南路线图,拟从7个议题全面推进协...
2025.12.16
ICH细胞与基因治疗讨论组(CGTDG)于12月11日正式发布一份战略建议文件。文件长达72页,内容全面丰富,针对先进疗法药品(ATMP)特别是细胞和基因治疗药物(CGT)的未来指南的制定与修订提出全面规划。
亟待协调:ICH成员发了300多份指南,定义和分类也未统一
ICH指出过去数年ATMP...
|
|
FDA 发布81份 BE 指南,包含多个国内有参比无指南...
2025.12.16
12月4日,FDA共发布了81份产品特定指南(PSG)草案,包括44份新指南和37份修订指南。54份PSG针对尚无获批ANDA的产品,其中包含19种复杂产品;28份PSG针对复杂产品,其中7份为新指南,21份为修订指南;
Lachman的仿制药专家Pollock指出值得关注的PSG涵盖银屑病首创外用疗法、脂溢性皮...
|

|
国际药政每周概要:EMA 核药、合成多肽药学指南,变...
2025.12.16
【早期开发与临床】
12.7,【ICH】M11 协同的电子结构化临床试验方案(CeSHarP)
12.8,【FDA】认证首款 AI 药物开发工具,将用于“MASH”临床试验
12.8,【EMA】药物基因组学研究质量管理规范指导原则修订的概念性文件
12.10,【WHO】B 群链球菌结合疫苗的质量、安全性...
|

|
国内药政每周导读:吉林海南加入补充申请试点,药典会...
2025.12.15
【注册与变更】
12.10,【NMPA】关于同意吉林、海南省药监局开展优化药品补充申请审评审批程序改革试点的批复
【生产质量】
12.11,【药典会】关于9406 细胞类制品微生物检查指导原则标准草案的公示
【新药批准和报产】
12.8-12.14,NMPA发布13个新药批准,CDE受理1...
|