|
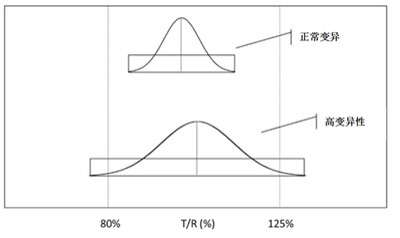
BE试验怎么做?如何审? - 高变异药物
2017.03.16
“预 BE 试验已经做到 18 例,受试者多一些才保险。”
“药物变异性高,已做到 120 多例,若再多一些例数就通过了,听说有企业这个产品都突破 150 例了。”
“这个是我们企业的主打产品,钱不是问题,多增加受试者,务必确保通过。”
“这个药物变异性太高,我们床位有限,一...
|

|
【研讨会】中美药监生物等效性会议第二轮通知
2017.03.14
转载自:北京大学药物信息与工程研究中心
2017年4月10-11日 北京友谊宾馆
主办单位:北京大学药物信息与工程研究中心
协办单位:上海东富龙科技股份有限公司
支持单位:中国药促会、亦弘商学院、识林知识平台
媒体支持:同写意、蒲公英
承办单位:艾美达(北...
|

|
【研讨会】中美生物等效性会议
2017.03.07
转载自:北京大学药物信息与工程研究中心
时间:2017年4月10-11日
地点:北京友谊宾馆
主办单位:北京大学药物信息与工程研究中心
协办单位:上海东富龙科技股份有限公司
支持单位:中国医药创新促进会、亦弘商学院、识林知识平台
媒体支持:同写意、蒲公英...
|

|
FDA修订二氟泼尼酯眼用乳液BE指南
2017.02.27
2月15日周三,FDA发布了题为“二氟泼尼酯指南草案”(Draft Guidance on Difluprednate)的生物等效性修订版指南草案。在修订文件中,FDA声明“提供生物等效性研究的设计的具体指导,以支持二氟泼尼酯乳剂的简化新药申请(Abbreviated new drug applications,ANDAs)”。
背景
20...
|

|
FDA更新生物等效性数据总结表模板
2017.02.13
美国FDA于2月9日更新了“生物等效性(BE)数据总结表模板”,对于简化新药申请(ANDA)提交的电子数据集,包括血浆浓度数据、药代动力学(PK)参数数据和其它使用数据域要求申请人参考临床数据交换标准协会(CDISC)的研究数据要求。
《注册申请的电子格式递交 — 标准化研究数据》定...
|

|
读者期待的《FDA生物等效性标准》专著中译本面世
2017.01.17
当前,仿制药质量与疗效一致性评价工作正如火如荼的开展。2018年底部分产品评价大限将至。行业面临重新洗牌。企业投入生物等效性(BE)研究的费用动辄几百甚至上千万元。
预BE研究的必要性及结果判断?减少受试者例数兼达到最佳BE研究结果的方法?科学、经济的BE研究方案?开展高变异、...
|

|
FDA 12月发布具体产品BE指南摘选点评
2017.01.03
美国FDA仿制药办公室(OGD)一直在生物等效性(BE)领域忙碌,其于12月22日发布的31篇新BE指南和17篇修订指南就证明了这一点。新增和修订BE指南清单请见此处。与往常一样,有一些具体产品的BE指南值得注意,而另外一些只是标准BE建议。以下是吸引了我们的目光的一些较为有趣的BE建议。
...
|

|
从一份具体产品BE指南的修订看原研商对产品的保护
2016.12.02
【编者按】多劳多得无可非议,若劳有至用。原研厂家结合药品的一些非最常见用法,从用药安全角度,提高标准从而加强防范,客观上起到了提高仿制药入市门槛的作用。关键在FDA是否认可这项安全防范的效用,及评判效用的科学和其它依据。此例显示了对药品的科学和医学以及对药品监管的法律法...
|

|
ICH M9将协调基于BCS的BE豁免
2016.10.21
2016年10月,ICH公布了M9基于生物药剂学分类系统的生物等效性试验豁免(Biopharmaceutics Classification System-based Biowaivers)的概念文件和业务计划。仿制药能否申请生物等效性试验豁免,是非常重要的内容。M9刚刚进入第一步(Step 1),值得期待。下文是M9概念文件内容的中文...
|

|
FDA发布针对两个专注达仿制药的撤市听证会通知
2016.10.18
10月17日,FDA通过两份联邦公报(FR)通告分别宣布两家公司的盐酸哌甲酯缓释片撤市听证会通知(NOOH, Notice of Opportunity for Hearing)【FR通告一
所有这些都发生在近两年前,现在FDA正在启动最后的行政措施以永久性的从市场上撤回这两个产品。
识林相关资讯
2015-08-19...
|
|
FDA具体产品生物等效性指南修订后的思考
2016.10.05
10月4日美国FDA发布67份具体产品生物等效性(BE)指南,其中34份新增33份修订,这是今年第三次批量发布和更新BE指南。FDA一直忙于放出新的BE指南和修订过去的指南文件。根据GDUFA II的新规定,仿制药办公室(OGD)将设定目标在最早合法批准日期至少两年之前针对90%的产品发布具体产品BE...
|
|
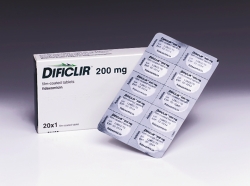
FDA发布非达霉素片剂BE指南并回应原研商请愿
2016.08.29
美国FDA于2011年5月批准Cubist制药公司的Dificid(非达霉素)200mg片剂,如万古霉素一样,用于治疗艰难梭菌相关的腹泻。两种药物均全身吸收差,治疗消化道和肠道局部病症。但是,万古霉素在生理学相关的溶出介质范围内比非达霉素更可溶。非达霉素的原研商Cubist于2015年5月7日提交了一份...
|
|
半年之内FDA再次修订帕利哌酮长效注射剂BE指南
2016.07.05
我们之前曾报道过FDA于2015年12月发布对用于肌肉注射的棕榈酸帕利哌酮长效注射剂混悬液生物等效性指南(BE)的修订【识林资讯-FDA修订帕利哌酮长效注射剂BE指南】。FDA于今年6月又发布了另一修订版本(2016年6月修订版草案)。
我们注意到有一些有趣的变化。之前我们介绍过2015年12...
|

|
依维莫司片两个不同BE指南的警示
2016.07.04
2016年6月最近更新的具体产品的生物等效性(BE)指南中,有一篇关于依维莫司(Everolimus)的BE指南(RLD 021560),该指南涵盖了治疗器官排斥反应中的药物使用。之前的指南文件(2011年3月首次发布,2012年6月修订)适用于肿瘤适应症的不同产品(RLD 022334)。
两个指南文件都提...
|

|
美国会议员寻求阻止制药商阻碍仿制药竞争
2016.06.19
在不到两年的时间内,美国国会议员第三次提出旨在结束仿制药生产商指控的品牌药品竞争对手用于阻挠竞争做法的法案。
品牌药生产商有时拒绝向仿制药公司提供样品,在这样的做法遭到不断投诉之际,由民主、共和两党联合提出的这一名为《创建和重建公平获取等效样品法案》)用于仿制药。为...
|
|
FDA对异丙酚注射剂的新BE要求
2016.06.19
6月16日FDA新发布19种药品的生物等效性(BE)指南,同时修订了另外19种药品的BE指南,其中一篇关于异丙酚注射剂的新发布BE指南引人关注。
所关注的问题涉及对产品配方定量(Q1)和定性(Q2)相同超出过去要求的新规定。对于大多数非肠道产品,只要申请人“鉴别和表征出存在的差异,并提...
|

|
CREATES议案能否帮助仿制药企业获得所需参照样品
2016.06.18
美国参议院司法委员会于6月14日提出《2016创建和重建公平获取等效样品法案(CREATES)》,旨在阻止对受限制的分销系统和风险评估与减轻策略(REMS)计划的滥用。这两个手段会如何阻碍可负担得起的仿制药的市场准入?
品牌药公司拒绝将产品样品销售给潜在的仿制药竞争者,从而使得仿制药...
|

|
FDA李冰博士访谈:局部作用鼻喷剂BE评价的新兴技术
2016.05.24
翻译自“FDA/CDER SBIA CHRONICLES”5月19日"FDA Embraces Emerging Technology for Bioequivalence Evaluation of Locally Acting Nasal Sprays“
采访人:Renu Lal博士
受访人:李冰博士
校译:识林-Kapok
FDA积极采用局部作用鼻喷剂生物等效性评价...
|

|
FDA具体BE指南修订给企业带来的难题
2016.05.13
随着时间的推移,我们都看到了FDA ANDA生物等效性(BE)指南文件草案或终稿形式的多种版本。在某些情况下,FDA做出相对较小的变化,但是在另外一些情况下,FDA会要求在数据收集、指标,有时候在研究设计方面要求重大修订。例如,FDA可能要求之前没有要求的进食研究。有时,FDA修订BE指南...
|

|
EMA开始审查基于印度CRO Semler研究的药品
2016.04.29
欧洲药品管理局(EMA)周五宣布,最近在印度班加罗尔工厂的检查发现严重数据可靠性违规后,正在审查依赖合同研究机构(CRO)Semler研究公司开展研究的所有欧盟授权药品。
EMA表示是基于最近来自美国FDA和世界卫生组织(WHO)的通知中提出的问题而开展的审查。据EMA表示,依赖于Semler开...
|