|
诺华开发 CAR-T 疗法快速制造平台,可将生产时间缩...
2022.12.13
嵌合抗原受体(CAR)T 细胞免疫治疗产品是人类基因治疗产品,其中 T 细胞特异性经过基因改造,能够识别用于治疗目的所需的靶抗原。但是 CAR-T 的制造耗时较长,患者在符合条件后通常需要等待数周才能接受治疗药的输注。对于一些患有侵袭性癌症的患者,他们可能会在等待治疗到来时死...
|

|
最高法院拒绝受理 BMS 诉吉利徳的 CAR-T 专利侵...
2022.11.09
昨日我们报道了美国最高法院同意受理安进诉赛诺菲关于高胆固醇治疗药 PCSK9 单抗的专利侵权案,而紧接着最高法院驳回了百时美施贵宝(BMS)子公司 Juno 诉吉利徳的 CAR-T 专利侵权案的审理请求。
先简单说一下这个案子的情况:2017年,Juno(BMS 旗下)对Kite pharma(吉利德...
|

|
多家药企敦促美最高法重审CAR-T专利侵权案,吉利德表...
2022.09.01
7月18日,Amgen、GSK和Regenxbio等多家制药公司和研究机构向美国最高法院(SCOTUS)提交了“法庭之友”意见书(amici briefs),称联邦巡回法院最近的一项关于CAR-T专利侵权诉讼的裁决违背了先例,可能会颠覆整个生物制药创新的生态系统,并表示支持百时美施贵宝公司(BMS)对吉利德“19...
|

|
合成细胞疗法已在路上,FDA需做好监管准备
2022.08.03
发展新的医疗手段需要推动或者打破目前的治疗定义边界,其中一个边界就是对细胞的定义。目前为止,细胞都是一种纯天然的存在(beings),我们用活细胞来繁殖活细胞。但随着合成生物学家及工程师正在不断学习和创造合成细胞(非活细胞),有朝一日合成细胞可能会改变一系列疾病的治疗方式。...
|

|
业界对FDA的CAR-T研发指南草案的代表性反馈
2022.07.27
3月初,FDA发布“嵌合抗原受体(CAR)T细胞治疗的研发考量”的行业指南草案,旨在帮助申请人开发CAR-T细胞产品,涵盖了关于CMC、药理学和毒理学以及临床研究设计方面的建议。虽然该指南是针对CAR-T细胞产品开发提出的,但提供的大部分信息和建议也将适用于其他转基因淋巴细胞产品,例如CA...
|

|
专利范围过广?药企等待美国高院裁决热点单抗和CAR-T...
2022.07.27
制药公司的目的是获利,往往不想把时间和金钱投入到因竞争而无法从中获利的事情上,因此市场上药物创新数量往往较少。为了防止这种市场失灵,专利保护机制应运而生。然而过去的十年,美国联邦上诉法院屡次裁定单克隆抗体药物以及CAR-T疗法的专利应遵循更严格的申请标准,激起原研公司不...
|

|
Nature 子刊论文:实体瘤 CAR-T 的关键挑战,以及...
2022.05.13
CAR-T 细胞治疗从根本上改变了血液系统恶性肿瘤的治疗格局。FDA 也在前不久发布了专门指南,见相关资讯:【FDA 发布 CAR-T 细胞治疗的研发考量指南草案】
CAR-T 治疗在血液肿瘤中的成功激发了人们对该技术在实体瘤中应用的热情。然而,实体瘤的生物学比血液系统恶性肿瘤更复杂。去年...
|
|
FDA对细胞和基因治疗产品的检查和常见缺陷统计
2022.03.30
细胞和基因治疗产品从早期研发逐步过渡到临床中后期和商业化生产阶段。个体化,“活”产品,医疗技术属性特点,使得细胞和基因治疗产品在生产等各环节具有高风险的特点。那么细胞和基因治疗产品在生产设施GMP合规方面高频缺陷如何?根据FDA对17个设施35次检查中签发的观察项发现:...
|
|
FDA 发布 CAR-T 细胞治疗的研发考量指南草案
2022.03.17
美国 FDA 于 2022 年 3 月 15 日发布了令人期待已久的《嵌合抗原受体(CAR)T 细胞治疗的研发考量》指南草案,旨在帮助申办人开发 CAR-T 细胞产品。
该指南的发布自 2020 年起就一直列在 FDA 生物制品审评与研究中心(CBER)的指南计划清单上,但拖到今年才正式出炉...
|
|
FDA 解除对 Allogene 现货型 CAR-T 癌症研究的...
2022.01.11
Allogene 于 2022 年 1 月 10 日表示,在获得美国 FDA 的安全性许可后,其现货型 CAR-T 疗法治疗血癌的临床试验正在恢复。
去年 10 月,在发现一名接受 Allogene 现货型 CAR-T 治疗的患者出现“染色体异常”后,FDA 暂停了五项 Allogene 的研究。但 Allogene 进...
|

|
监管专家谈细胞治疗产品
2021.10.27
2021年10月14日,“第五届中国药品监管科学大会 — 细胞治疗产品开发与监管分论坛”召开。分论坛云集了16位来自学术界、产业界和监管机构的专家,就细胞治疗产品的研发现状、全球监管、国内注册审评/检验/GMP生产管理展开讲座。
继今年6月,国内首个细胞治疗产品(CAR-T) — 复...
|

|
百时美施贵宝新 CAR-T 工厂将实现自动化和虚拟现实...
2021.05.05
随着越来越多细胞疗法的涌现,如何快速可靠地制造个体化药物成为现实问题。百时美施贵宝(BMS)对新建的两个细胞疗法工厂正在实现自动化和高科技培训。
BMS 最近获批的 CAR-T 药品 Breyanzi 和 Abecma 都是高度个体化的生产过程:使用血液成分置换程序直接从患者体内收集 T ...
|

|
FDA 批准首个多发性骨髓瘤 CAR-T 疗法
2021.03.29
美国 FDA 于 3 月 26 日批准了首个针对晚期多发性骨髓瘤患者的个性化细胞疗法百时美施贵宝(BMS)公司的 Abecma。
FDA 批准 Abecma 用于治疗对至少四种不同类型的既往治疗方法没有应答或者治疗后复发的多发性骨髓瘤患者。BMS 和 Bluebird 表示治疗费用将为 419,500 美元。...
|

|
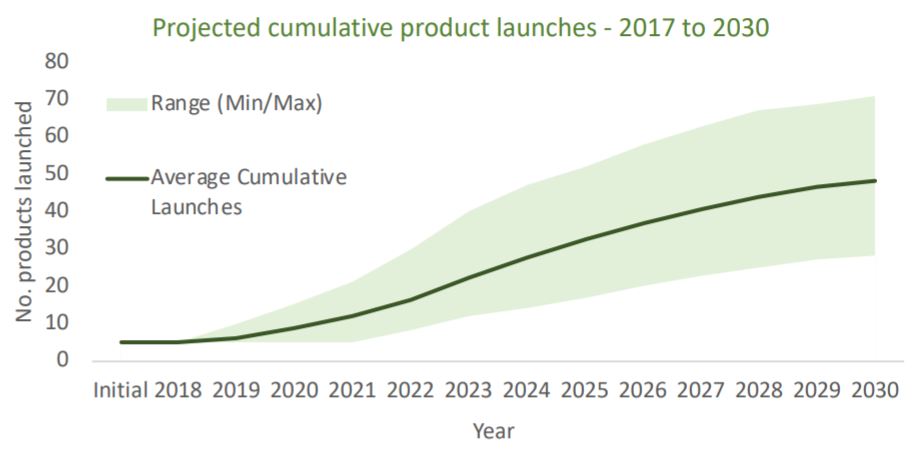
欧盟基因和细胞治疗药物开发指南,含 CAR-T 细胞的...
2020.12.21
欧洲药品管理局(EMA)更新了其针对具有转基因细胞的新药开发的行业指南,其中包括有关嵌合抗原受体 T(CAR-T)细胞治疗药物的特殊临床考虑的附录。新指南指出,“EMA 已经认识到,这是一个不断发展的领域,指南应可以在合适的情况下应用于任何新产品。”
这份 36 页的指南提供了...
|
|
FDA 计划发布 CAR-T 治疗产品制造指南
2020.11.09
美国 FDA 生物制品审评与研究中心(CBER)主任 Peter Marks 表示,FDA 正在制定关于 CAR-T 细胞疗法生产的新指南以提供更清晰的监管期望信息。但他表示尚不确定指南什么时候会发布出来。
日前,在遗传工程和生物技术新闻(GEN)举办的题为“生物制造在细胞和生物治疗产品中起...
|

|
CBER 2020 指南计划关注基因组编辑、CAR-T疗法等大...
2020.02.17
美国 FDA 生物制品审评与研究中心(CBER)于 2 月 14 日发布 2020 年指南制定计划,其中一些新指南草案针对越来越热门的药品研发领域。
今年有三篇指南很可能会引起业界和其他利益相关者的大量关注和评论。这三篇指南讨论了嵌合抗原受体(CAR)T 细胞治疗的研发,结合基因组编...
|

|
C-Jun 的过表达可诱导 CAR-T 细胞产生衰竭抵抗
2019.12.14
作为 FDA 批准的首例基因治疗方法,嵌合抗原受体(chimeric antigen receptor,CAR)T细胞疗法为白血病、霍奇金淋巴瘤患者带来了福音,但对实体瘤的治疗效果并不稳定。近两年来,随着 CAR-T 细胞的研究不断深入,越来越多的研究结果证明这一疗法引起的副作用依然不容小觑,在患...
|

|
识林线下会简报:CAR-T细胞产品的监管路径与合规挑战
2019.11.14
2019年11月11日,识林与Hogan Lovells律所在上海联合举办了主题为“CAR-T细胞产品的监管路径与合规挑战”的线下交流会。君实生物高级副总王刚博士、药明生基医药科技总经理姚树元博士以及Hogan Lovells律所的五位律师出席会议,并为到场的70余位业界人士带来报告,会议由卓见医药联合创...
|

|
CAR-T 细胞产品生产质量管理的难点
2019.11.06
CAR-T细胞治疗是当前国内药业发展的重要方向之一,目前国内已有近30家企业,未来还会有更多加入。类似的是,CAR-T类细胞治疗还在研发阶段,就已注定面临激烈竞争;不同的是,细胞、质粒等特殊的工艺控制和无菌操作要求,CAR-T类细胞治疗的工艺合规与质量安全更为重要和困难。
2019年1...
|
|
美联邦医保计划将为 CAR-T 疗法提供全国性覆盖
2019.03.12
根据一项新提案,美国 Medicare 计划(针对老年人和残疾人的联邦医疗保险)将为全国患者支付昂贵的新型癌症治疗药物 — CAR-T 基因疗法。
美国医疗保险与医疗补助服务中心(CMS)于 2 月 15 日发布了一份国家医疗保险覆盖决定提案。提案规定,在治疗符合一定标准的前提下,包括登记(...
|