
|
问题征集 细胞和基因治疗产业化调研报告和检查缺陷分...
2023.03.22
细胞和基因治疗的产业化,离不开合适的产业和监管生态。我国细胞和基因治疗产业化的现状和困难是怎样的?2022年识林在日立生命科学解决方案事业部的支持下,调研了11家国内代表企业,并完成调研报告。其中数据显示,监管政策和产业化经验是CGT产业化的最大挑战,这也是识林联合IPEM及中国...
|

|
【识林解读与案例】细胞GMP,9-10月欧美批准,483综...
2022.12.03
在官方发布的法律法规、指导原则之外,识林原创、汇编、搜集了大量对比、解读、案例、解析等内容,作为识林用户学习法规指南的辅助,提供更多视角,且与岗位实务联系更为紧密。
这类资料,全部收录在刚刚开发的【对比解读案例解析】数据库内(点击查看使用介绍),通过“业务标签”和“...
|

|
【识林问答短视频】生物制品配液,共线评估,除菌过滤...
2022.11.19
识林提倡“知识导向”,严肃地阅读,系统性听课,需要投入大量时间,从而获取认知层面的提升。当然,企业用户提升认知的目标,还是解决更多、更复杂的问题。
在“问题导向”方面,【识林社区】在向导老师们的支持下,努力做到“有问必答”,而【识林问答短视频】则是从识林数...
|

|
线上讲座:细胞治疗产品生产用物料的选择要点与评价
2022.11.17
起始物料和原料的质量是药品生产时要考虑的关键因素。对于细胞治疗产品而言,由于起始原材料(如生产用细胞)的特殊性和工艺的复杂性,对细胞治疗产品的生产和质量管理带来较大的挑战。因此,在细胞治疗产品的质量控制策略中需要着重考虑起始原材料的变异性、生产工艺的复杂性以及生产批...
|

|
先进治疗产品申请喷发员工流失,FDA 细胞和基因治疗...
2022.09.28
美国 FDA 生物制品审评与研究中心(CBER)下的组织和先进治疗办公室(OTAT)主任 Wilson Bryan 近日在美国细胞和基因治疗学会的政策峰会上表示,其办公室负责监管的细胞和基因治疗产品工作量已超过 3000 件活跃的研究性新药申请(IND)。
Bryan 表示,这一巨大的工作量已经使得一些...
|

|
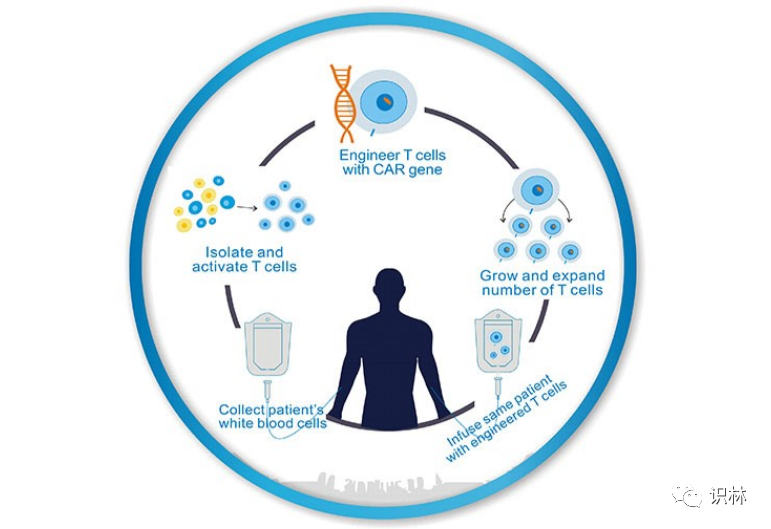
力求趋同,WHO制定细胞和基因治疗产品全球监管框架
2022.07.14
基于细胞、组织和基因的疗法和产品涵盖较广,从相对简单的(例如未加工的自体细胞和组织移植物)到高度复杂的(例如转基因细胞)均有涉及。许多国家已经建立了反映这类疗法和产品的多样性和复杂性的有效的法律框架和法规,以保护捐赠者和接受者的安全。
医疗用人体细胞和组织(HCTs...
|
|
对于细胞和基因治疗产品,与临床研究阶段相适应的GMP...
2022.07.01
细胞和基因治疗产品产业持续发展,从发现研究阶段逐步进入临床开发并过渡到中后期和及商业化生产阶段,产品的质量、合规以及适当的标准成为需要考虑的必要要素,到了是否准备好开始GMP生产的决策点。
在着手考虑这些要素的组织或机构,包括成熟的大/中型生物药企业、初创公司、以及学...
|

|
应对基因和细胞治疗审评的巨大挑战,FDA的OTAT办公室...
2022.06.21
近年来,基因和细胞治疗研究性新药申请和相关会议的爆炸性增长大大超过了CBER属下的组织和先进疗法办公室(Office of Tissues and Advanced Therapies,OTAT)人员的增幅,由于资源限制,OTAT不得不拒绝许多申办者的会议请求。
为了满足领域快速发展带来的需求,提高自己与...
|

|
工艺验证中供者细胞选择和最大产能考量,CDE免疫细胞...
2022.06.02
5月31日,CDE在《免疫细胞治疗产品药学研究与评价技术指导原则》“征求意见(2020.09.30)”的基础上发布“试行”版本,并于发布之日起施行。
两版之间存在多处调整,在大的框架上,试行稿不再单独设置“工艺变更”和“环境和生物安全性”章节,而是在一般原则中概述性提及;在细...
|

|
细胞和基因治疗的生产、临床终点和报销问题,ASGCT ...
2022.05.25
基因疗法领域的前沿国际学术会议——美国基因与细胞治疗年会(ASGCT)于5.16-5.19日在华盛顿特区线下召开。
美国基因和细胞治疗学会(ASGCT)创立于1996年,是一家总部位于密尔沃基的专业非营利性医学和科学组织,提供了一个国际化平台,供从业者们介绍和批判性讨论前沿基因和细...
|
|
FDA对细胞和基因治疗产品的检查和常见缺陷统计
2022.03.30
细胞和基因治疗产品从早期研发逐步过渡到临床中后期和商业化生产阶段。个体化,“活”产品,医疗技术属性特点,使得细胞和基因治疗产品在生产等各环节具有高风险的特点。那么细胞和基因治疗产品在生产设施GMP合规方面高频缺陷如何?根据FDA对17个设施35次检查中签发的观察项发现:...
|
|
FDA 发布 CAR-T 细胞治疗的研发考量指南草案
2022.03.17
美国 FDA 于 2022 年 3 月 15 日发布了令人期待已久的《嵌合抗原受体(CAR)T 细胞治疗的研发考量》指南草案,旨在帮助申办人开发 CAR-T 细胞产品。
该指南的发布自 2020 年起就一直列在 FDA 生物制品审评与研究中心(CBER)的指南计划清单上,但拖到今年才正式出炉...
|
|
FDA 解除对 Allogene 现货型 CAR-T 癌症研究的...
2022.01.11
Allogene 于 2022 年 1 月 10 日表示,在获得美国 FDA 的安全性许可后,其现货型 CAR-T 疗法治疗血癌的临床试验正在恢复。
去年 10 月,在发现一名接受 Allogene 现货型 CAR-T 治疗的患者出现“染色体异常”后,FDA 暂停了五项 Allogene 的研究。但 Allogene 进...
|

|
监管专家谈细胞治疗产品
2021.10.27
2021年10月14日,“第五届中国药品监管科学大会 — 细胞治疗产品开发与监管分论坛”召开。分论坛云集了16位来自学术界、产业界和监管机构的专家,就细胞治疗产品的研发现状、全球监管、国内注册审评/检验/GMP生产管理展开讲座。
继今年6月,国内首个细胞治疗产品(CAR-T) — 复...
|

|
定价分析机构如何评价高价基因和细胞治疗产品的成本效...
2021.06.22
从表面上看,新药的价格越高,其开发者似乎就越难获得药品价格监督机构 — 临床与经济评价研究所(ICER)的认可。对于快速发展的基因和细胞治疗领域的公司而言,这将使 ICER 的审查成为一个难以克服的障碍,尤其是如果该机构的意见在未来确定保险覆盖范围的决定中具有更大权重的话。
...
|
|
FDA 计划发布 CAR-T 治疗产品制造指南
2020.11.09
美国 FDA 生物制品审评与研究中心(CBER)主任 Peter Marks 表示,FDA 正在制定关于 CAR-T 细胞疗法生产的新指南以提供更清晰的监管期望信息。但他表示尚不确定指南什么时候会发布出来。
日前,在遗传工程和生物技术新闻(GEN)举办的题为“生物制造在细胞和生物治疗产品中起...
|
|
WHO 计划发布细胞和基因疗法监管趋同白皮书
2020.07.09
WHO 计划很快发布白皮书,提出针对细胞和基因疗法的统一监管框架,促进中低收入国家的患者获得这些产品并增加商业可行性。美国 FDA 生物制品审评与研究中心(CBER)主任 Peter Marks 最近在由 PDA 主办的有关先进治疗药物产品的网络研讨会上如是表示。
Marks 在会上还讨论了将...
|
|
哈佛、MIT及一批行业领导者将联合开办生物制造工厂
2019.11.26
哈佛大学 11 月 25 日宣布,一批领先的波士顿地区大学、医院和公司将在波士顿市内或附近建立一个新的生物制造和创新中心,以期捍卫该地区在生命科学领域的领导地位。这一领导地位正受到生物制造方面严重瓶颈的威胁。
哈佛大学公共事务副校长 Kevin Casey 表示,该制造中心将于 20...
|

|
识林线下会简报:CAR-T细胞产品的监管路径与合规挑战
2019.11.14
2019年11月11日,识林与Hogan Lovells律所在上海联合举办了主题为“CAR-T细胞产品的监管路径与合规挑战”的线下交流会。君实生物高级副总王刚博士、药明生基医药科技总经理姚树元博士以及Hogan Lovells律所的五位律师出席会议,并为到场的70余位业界人士带来报告,会议由卓见医药联合创...
|

|
CAR-T 细胞产品生产质量管理的难点
2019.11.06
CAR-T细胞治疗是当前国内药业发展的重要方向之一,目前国内已有近30家企业,未来还会有更多加入。类似的是,CAR-T类细胞治疗还在研发阶段,就已注定面临激烈竞争;不同的是,细胞、质粒等特殊的工艺控制和无菌操作要求,CAR-T类细胞治疗的工艺合规与质量安全更为重要和困难。
2019年1...
|