
|
分步提交,快速审评?FDA的STAR计划可能遥不可及
2022.07.15
FDA分步实时申请审评计划(Split Real Time Application Review,STAR)原本令行业充满热情,然而它的认定几乎与突破疗法认定一样难,可能给药企泼了冷水,这种情况与实时肿瘤学审评(Real-Time Oncology Review,RTOR)非常相似。FDA在实践中体会实时审评的优势,计划将RTOR扩展到...
|

|
过去十年批准的新药仅不到三分之一具有高治疗价值
2020.10.14
最近一项发表在《英国医学杂志》(BMJ)上的研究1发现,2007 年至 2017 年十年间,美国 FDA 和欧洲药品管理局(EMA)批准的新药中只有不到三分之一具有高治疗价值。但是,分析发现,通过加快审评计划(尤其是 EMA 的加快审评计划)批准的药物可能有更高的比例具有高治疗价值。
...
|

|
肿瘤中心主任谈加速审批及新冠康复患者临床试验入组问...
2020.06.23
对多种加快路径做减法,系统化;如何更好地让新冠康复者参加临床试验
自美国 FDA 推出加速审批以来已经过去了将近三十年,现在是时候应该重新审视该路径以及 FDA 的所有加快计划了。FDA 肿瘤卓越中心主任 Richard Pazdur 在接受采访时表示,希望肿瘤学界重新审视 FDA 加速审...
|

|
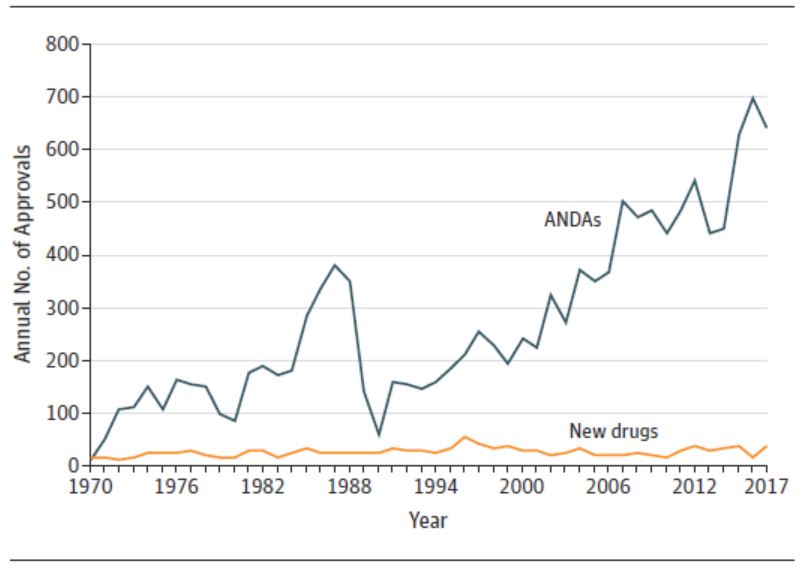
支持 FDA 药品批准所需关键临床试验数量呈下降趋势
2020.04.24
纵观过去 30 年间美国 FDA 对新药和生物制品的批准,越来越多的批准使用加快审评程序,并且所需关键试验有所减少。
4 月 21 日发表在 JAMA Network Open 上的一篇研究文章《1995-2017 年支持美国 FDA 新药批准的临床试验评价》1汇总了 1995-2017 年间 FDA 批准的 2...
|
|
过去四十年 FDA 新药审批改革成效如何,需再次改革...
2020.01.16
1 月 14 日发表在 JAMA 上的一篇题为“1983-2018 FDA 药品批准和监管”的通讯文章引发了业界的广泛关注,文章认为美国 FDA 在过去四十年中进行的加快审评的改革可能需要进一步做出改变。文章作者为哈佛医学院布莱根妇女医院医学系的 Jonathan Darrow 等人。
总体而言,文章...
|

|
欧美监管机构将着眼于加快审评方面的合作
2019.04.12
美国和欧盟监管机构正在考虑建立一个关于加快审评合作的试点计划,在这一试点计划下,双方将针对两方的加快审评计划,相互讨论他们提供给肿瘤学领域公司的科学建议。试点中的加快审评计划指的是美国 FDA 突破性治疗药品(BTT)计划和欧洲药品管理局(EMA)的优先药品计划(PRIME)。
...
|

|
FDA的NDAs和BLAs PAS补充申请的加快审评效仿ANDA
2018.04.27
4月23日,药品质量办公室(OPQ)公布了“MAPP 5310.3针对CMC变更的NDA和BLA PAS的加快审评请求”。该文件在很大程度上效仿了仿制药PAS优先审评资格的政策和流程,后者详见 FDA MAPP Prioritization of the Review of Original ANDAs, Amendments, and Supplements。...
|

|
FDA批准第二例生产治疗罕见病药的转基因动物
2015.12.13
2015年12月8日,FDA发布针对一个独特产品的复杂批准 –Kanuma(sebelipase alfa)。Kanuma是首个用于罕见病溶酶体酸性脂肪酶(LAL)缺乏患者的治疗药物。
LAL缺乏症(也称为沃尔曼病和胆固醇酯贮积病CESD)患者没有或者有很少的LAL酶活性,这导致不同组织细胞中脂肪的堆积,从而导致...
|

|
关于重大新药创制科技重大专项拟推荐优先审评药物品种...
2015.11.25
为加快重大新药创制科技重大专项创新成果产出进程,根据有关规定和专家评审遴选建议,拟推荐磷酸源生萘啶等11个专项支持的药物品种为优先审评品种。
现将拟推荐的品种予以公示。公示时间为2015年11月25日至2015年12月8日。如有异议,请实名反馈至我办。
联系电话:010-6879185...
|

|
关于重大新药创制科技重大专项拟推荐优先审评的药物品...
2015.09.14
为加快重大新药创制科技重大专项创新成果产出进程,根据专家评审遴选建议,拟推荐CT-707等17个专项支持的药物品种为优先审评品种。
现将拟推荐的品种予以公示。公示时间为2015年9月14日至2015年9月25日。如有异议,请实名反馈至我办。
联系电话:010-68791854
传 真:010-6...
|

|
有关FDA优先审评券的五个关键更新
2015.09.04
这篇文章中,我们着重关注与FDA热带疾病和罕见儿科疾病(“儿科”)相关的优先审评券(PRV)项目的5个关键更新:
1. 联合治疗公司(“联合治疗”)以3.5亿美元的价格出售其儿科PRV;
2. FDA在热带疾病资格名单中增加美洲锥虫病和脑囊虫病;
3. 赛诺菲-安万特(“赛...
|

|
关于重大新药创制科技重大专项拟推荐优先审评的药物品...
2015.05.05
为加快重大新药创制科技重大专项(以下简称“新药专项”)创新成果产出进程,根据有关文件规定和专家评审遴选建议,拟推荐希列克托灵等21个专项支持的药物品种为优先审评品种。
现将拟推荐的品种予以公示。公示时间为2015年5月4日至2015年5月15日。如有异议,请实名反馈至我办。
...
|
|
FDA最快创新药审评仅用6天
2015.03.04
FDA今日批准百时美施贵宝的Opdivo用于肺癌治疗(此前已经获得批准用于黑色素瘤),该申请上周五才被FDA接收,仅用不到一周的时间便获得了批准,比预期时间表提早3个多月。该药的治疗机理是通过阻断一种名为PD-1的途径 – 这种途径如不加控制,将允许癌细胞通过人体天然防御体系而不被发...
|

|
FDA加速批准可支持针对严重病症的更小规模试验
2014.06.11
摘要 关于加速监管路径的最终指南建议FDA针对一些严重病症开放加速批准;FDA还提供了除HIV/肿瘤领域之外的替代和中间临床终点支持的批准示例。
FDA药品和生物制品加快审评计划的最终指南,对于严重病症采取了比该文件较早的草案版本更受欢迎的方法进行加速批准。
“用于严重病症的...
|

|
FDA批准Imbruvica用于罕见血癌治疗
2013.11.18
FDA批准第二个突破性疗法认定药品Imbruvica用于罕见血癌治疗
2013年11月13日
美国食品药品管理局(FDA)于日前批准Imbruvica (Ibrutinib)用于套细胞淋巴瘤(MCL)患者的治疗,该疾病属于一种罕见的侵润性血癌。
MCL是一种罕见的非霍奇金氏淋巴瘤,在美国所有非霍奇金氏淋...
|

|
FDA批准首个突破性治疗认定药品
2013.11.05
临床试验人数的多少,并非突破性治疗药品的热点。Gazyva的重要性在于,是首个真正意义上通过这一通道获批的药品。见下文。
FDA批准首个突破性治疗认定药品
2013年11月1日,FDA宣布首个通过突破性治疗药品通道审评的药品获批,这一新的审评通道旨在加速审评流程,使非常有前途的...
|

|
FDA突破性治疗路径
2013.10.12
概述
2012年7月9日,美国食品药品管理局安全和创新法案(FDASIA)正式成为美国的法律。在原有的快速通道、加速批准、优先审评等三条特别审评通道的基础上,FDASIA第902条提出了一项新途径:新药物的“突破性治疗认证”(Breakthrough Therapy Designation)。今年6月25日,FDA发布...
|

|
【人物】专访SFDA注册司司长王立丰
2013.03.04
审评审批改革:创新与突破——专访国家食品药品监管局药品注册司司长王立丰
2013年03月04日 发布
近日,国家食品药品监管局发布的《关于深化药品审评审批改革进一步鼓励创新的意见》(以下简称《意见》)备受业界关注。《意见》在转变创新药审评理念、调整仿制药审评策略、加强...
|

|
《关于深化药品审评审批改革进一步鼓励创新的意见》
2013.02.26
国家食品药品监督管理局关于深化药品审评审批改革进一步鼓励药物创新的意见
发布日期:20130226
国食药监注201337号
各省、自治区、直辖市食品药品监督管理局(药品监督管理局):
为推进药品审评审批改革,加强药品注册管理,提高审评审批效率,鼓励创新药物和具有临...
|