
|
FDA 修订了仿制药申请审评优先级政策 20200130
2020.01.30
FDA revises generic drug application prioritization policy to ensure fairness to applicants, efficiently allocate limited agency resources, and protect the public health
Today, the U.S. Food and Drug Administration published a revision to Manual of ...
|

|
FDA 新型冠状病毒疾病诊疗产品开发重点措施
2020.01.29
2020年1月27日,美国食品和药物管理局(FDA)宣布采取推进新型冠状病毒诊疗产品开发的重点措施。
FDA 表示:同面对其他公共卫生威胁一样,FDA 将与相关合作机构、药品研发机构、国际合作机构和全球监管机构共同合作,加快诊断、治疗、缓解和预防此类疫情所需医疗产品的开发和供应。
...
|

|
FDA 持续大力支持基因治疗产品的研发创新 20200128
2020.01.29
FDA Continues Strong Support of Innovation in Development of Gene Therapy Products
This is a pivotal time in the field of gene therapy as the FDA continues its efforts to support innovators developing new medical products for Americans and others aro...
|

|
FDA 抗病毒产品紧急研究用新药申请
2020.01.28
近日识林接连介绍了有关【抗病毒药物在治疗武汉冠状病毒感染中的作用】,以及【公共卫生紧急情况下未批准药品的临时授权使用】。今天我们来看看处于临床阶段(IND)的抗病毒产品紧急使用的程序与做法。
根据美国 2009 年发布的《研究用药品扩大用于治疗用途最终规定》,FDA 扩大使用(ex...
|

|
【更新提示】识林一周回顾(20200120-0126)
2020.01.27
【EMA】新增GMP和MAH思考性文件(01.21)资讯
该指南系统的梳理了欧盟MAH的法规体系,及其和相应GMP文件的对应关系。该文件讨论了截至2019年4月与MAH相关的所有GMP指南。但是这份文件是静态的,不能持续跟踪这些法规的变化,它列出了MAH与GMP相关的一般职责和活动,按不同主题在第5章...
|

|
【周末杂谈】公共卫生紧急情况下未批准药品的临时授权...
2020.01.26
药品上市通常走上市前研究和上市申请的监管(regulatory)模式(仿制药和非处方药是其特例)。但在特殊情况下,就像现在由武汉冠状病毒感染所引发的公共卫生紧急情况下,还有另一种模式,即紧急使用授权(Emergency Use Authorization, EUA)模式,也可称为公共卫生模式(public healt...
|

|
来自欧盟的专业贺礼 – MAH和GMP法规体系官方梳理
2020.01.23
前天,EMA公布了GMP和MAH思考性文件的征求意见稿(Reflection paper on good manufacturing practice and marketing authorisation holders)。该指南系统的梳理了欧盟MAH的法规体系,及其和相应GMP文件的对应关系,识林正在翻译这份指南,并建设该专栏。
MAH相关法规指南数量...
|

|
FDA 批准首个上皮样肉瘤的治疗方案 20200123
2020.01.23
FDA approves first treatment option specifically for patients with epithelioid sarcoma, a rare soft tissue cancer
Today, the U.S. Food and Drug Administration granted accelerated approval to Tazverik (tazemetostat) for the treatment of adults and pe...
|

|
【转载】药品说明书的规范性与风险控制 — 以新型抗...
2020.01.22
摘要:药品说明书是载明药品重要信息的法定文件,也是控制药品风险的重要工 具。如何规范撰写说明书,是每个药品上市许可持有人都面临的问题。目前在肿 瘤治疗领域,随着对肿瘤发病机制研究的不断深入,越来越多的创新药获批上市, 改善了广大肿瘤患者的生存预后。本文以抗肿瘤药为例...
|
|
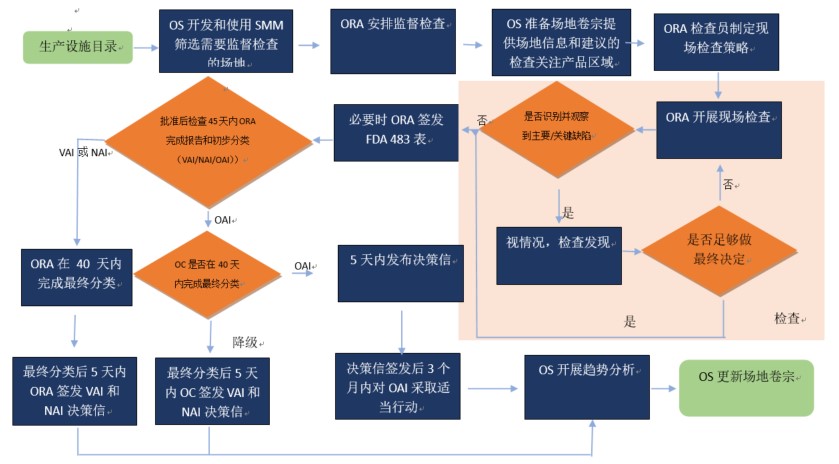
GMP 检查结束到最终合规判定的 90 天发生了什么?
2020.01.22
遇到过几家企业,检查结束后感觉不错,也没感觉FDA检查员说什么严重的,但最后结果是OAI(Official Action Indicated, 官方行动指示,即检查不通过),甚至还吃了警告信,那么检查之后FDA内部是怎样的流程呢?
FDA 90天合规判定的绩效逐步实现
根据GDUFA II,FDA承诺在检查结束...
|

|
FDA批准Tepezza治疗甲状腺眼病
2020.01.21
FDA approves first treatment for thyroid eye disease
FDA批准治疗甲状腺眼病的新疗法
Today, the U.S. Food and Drug Administration (FDA) approved Tepezza (teprotumumab-trbw) for the treatment of adults with thyroid eye disease, a rare condition where ...
|

|
FDA公布第二次防晒霜吸收的研究结果
2020.01.21
FDA announces results from second sunscreen absorption study
The following quote is attributed to Janet Woodcock, M.D., director of the FDA’s Center for Drug Evaluation and Research.
“Given the recognized public health benefits of sunscreen use,...
|

|
FDA 受新药办公室改组影响的申请
2020.01.21
Applications Affected by the Reorganization of the Office of New Drugs
+
Applications
OND Reorg affected applications p3 (XLS - 2MB)
The approved restructuring of the Office of New Drugs (OND) creates offices that align interrelated disease ...
|

|
敲低髓样抑制细胞GCN2可解除肿瘤微环境中的免疫抑制作...
2020.01.21
肿瘤微环境(Tumor microenvironment, TME)中的癌细胞、T细胞和髓样细胞之间的相互作用是肿瘤发展的关键因素,一般认为,CD8+ T细胞的浸润可抑制肿瘤发展,而髓样抑制细胞(myeloid-derived suppressor cells,MDSCs)和肿瘤相关巨噬细胞(tumor-associated macrophage,TAMs)...
|

|
【更新提示】识林一周回顾(20200113-0120)
2020.01.20
【国家医保局】关于开展第二批国家组织药品集中采购和使用工作的通知(01.17);【政策解读】
国家医保局、国家卫生健康委、国家药监局等部门在总结“4+7”试点和扩围政策、做法基础上,形成了第二批国家组织药品集中采购和使用工作思路。第二批国家组织药品集中采购和使用仍以带量采...
|

|
Keytruda 新增膀胱癌适应症人群
2020.01.20
FDA于2020年1月8日批准PD-1抑制剂Keytruda用于治疗卡介苗(BCG, Bacillus Calmette-Guerin)治疗无效的高风险非肌层浸润性膀胱癌(NMIBC, non-muscle invasive bladder cancer),原位癌(CIS)伴随或不伴随乳头状瘤,且不符合或已选择不进行膀胱切除术的患者。
背景
尿路...
|

|
【周末杂谈】读纽约时报社论:困境中的FDA
2020.01.19
2020年1月11日,美国纽约时报发表社论“困境中的FDA。如何改进 - 对新局长的工作建议”(The FDA Is in Trouble. Here's How to Fix It - Some New Year’s resolutions for the incoming boss),对FDA近年来的一些所作所为,提出了尖锐的批评。请注意,纽约时报...
|

|
FDA 药品中心主任谈在云端建立全球质量档案
2020.01.18
美国 FDA 药品审评与研究中心(CDER)主任 Janet Woodcock 指出,解决日益严重的国际药品制造质量要求冲突问题的唯一途径是建立全球质量档案。
她在 12 月份的 PDA 质量风险管理会议上分享了关于这一愿景的一些想法,如果实现这些想法,不仅可以简化新药的生产,而且可以持续...
|

|
欧盟药品短缺网络试点进入第二阶段
2020.01.17
欧洲药品管理局(EMA)和药品机构(HMA)于2016年12月成立了HMA/EMA人用和兽用授权药品供应https//www.hma.eu/522.html 特别工作组,以提供战略支持和建议,来解决人用药和兽药供应中断的问题,并确保其持续供应。其主要优先事项包括
研究如何利用现有的监管框架(例如,通过工...
|

|
FDA利用技术和合作来支持罕见病药品研发
2020.01.17
FDA Harnesses Technology and Collaboration to Support Rare Disease Product Development
Announcing an Orphan Drug Technology Modernization effort and the 2020 FDA Rare Disease Day meeting
By Amy Abernethy, M.D., Ph.D., Principal Deputy Commissione...
|