|
过去四十年 FDA 新药审批改革成效如何,需再次改革...
2020.01.16
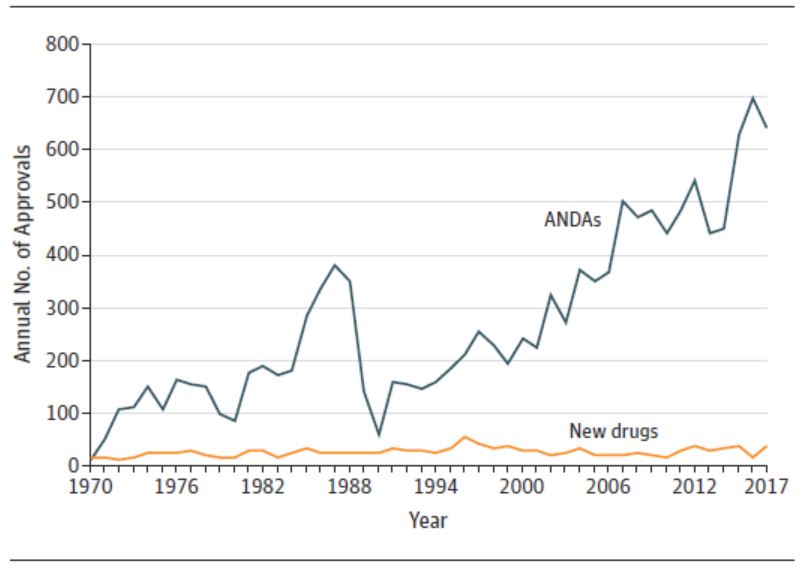
1 月 14 日发表在 JAMA 上的一篇题为“1983-2018 FDA 药品批准和监管”的通讯文章引发了业界的广泛关注,文章认为美国 FDA 在过去四十年中进行的加快审评的改革可能需要进一步做出改变。文章作者为哈佛医学院布莱根妇女医院医学系的 Jonathan Darrow 等人。
总体而言,文章...
|

|
“液体活检”技术又有新突破 — ctDNA的甲基化标记...
2020.01.16
结直肠癌(colorectal cancer,CRC)是全世界第三大高发的致命癌症,与所有癌症一样,越早得到确诊和治疗,患者预后越好、生存率越高。通常认为,肠镜检查是CRC早期诊断和筛查的最佳检测方法,但由于其侵入性较强,且有可能导致并发症,往往会使病人产生抗拒心理。因此,尽早发现具备高特...
|

|
FDA 新十年的大麻政策
2020.01.15
Cannabis Policies For the New Decade
Testimony of
Douglas Throckmorton, M.D.
Deputy Director for Regulatory Programs - Center for Drug Evaluation and Research CDER
Before the
https//energycommerce.house.gov/subcommittees/health-116th-congress...
|

|
中国和PICS的2020工作计划
2020.01.15
2020年1月1日,PIC/S迎来了第53个成员机构,意大利兽医药局(Italian Veterinary Agency, DGSAF)。另外巴西已经接近了PIC/S评估程序的尾声,而俄罗斯已经完成了预评估程序。被选任2020-2021年PIC/S主席的Anne Hayes在去年12月30日的发布会上,谈到了2020年PIC/S的计划和优先级。Ha...
|
|
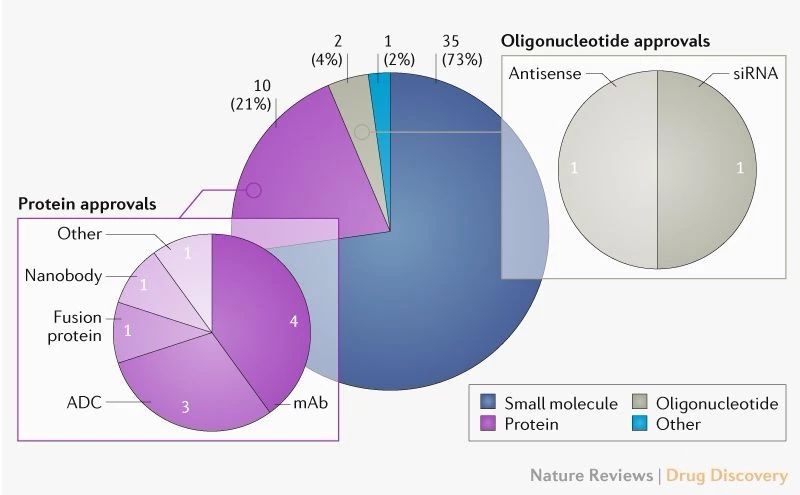
【转载】Nature子刊:2020年FDA可能批准的新药
2020.01.14
2019年,FDA 的药品评价与研究中心(CDER)共批准了48款新药上市,虽然数量上低于2018年的59个,但是这个数字仍是过去25年的第3高。FDA最近连续5年的平均批准新药数量达到了44个,这个数字是2005-2009年平均批准新药数量(22个)的2倍。
FDA在新药审批方面给予的政策激励也能解释...
|

|
2019 年中国企业不合格 483(OAI)细读
2020.01.14
注:在研究过程中,我们发现FDA提供的清单存在显著缺失,不少识林483数据库中已经收录的483并没有在其中体现,FDA对此备注说:并非所有的检查都收录在数据库里,不包括州检查、批准前检查、专论设施检查、等待最终执法行动的检查和非临床实验室检查。如果大家还发现有其它类型的缺失信息,...
|

|
【更新提示】识林一周回顾(20200106-0112)
2020.01.13
【NMPA】国家药监局综合司公开征求《化学药物中亚硝胺类杂质研究技术指导原则(征求意见稿)》意见(01.11)
指导原则指出申请人应切实履行药品质量管理的主体责任,对药品的安全和质量进行全生命周期管理,尽可能的避免亚硝胺类杂质的引入,若确不能完全避免的,应充分评估药品中亚硝...
|

|
可见颗粒物污染的生命周期解决方案
2020.01.13
可见的颗粒物污染是导致注射剂批次被拒绝或召回的主要原因之一,在2009年至2019年间,发生在美国的注射剂召回事件中,存在异物颗粒问题是仅次于缺乏无菌性保证的原因。美国注射剂协会(Parenteral Drug Association, PDA)2015年对注射剂生产商的调查显示,上年度:
43%的受访者由...
|

|
【周末杂谈】OAI、透明公开监管与产业发展
2020.01.12
上月11日,在美国食品药品法研究所在华盛顿举行的一次会议上,FDA药品审评和研究中心合规办公室(Office of Compliance,OC)主任D. Ashley高兴地报告,2019财年(9月30日截至),在GMP检查后90天(本文引用的都是自然天,不是工作日)内,OC完成了86%的检查结果分类,比2018财年增加...
|

|
【全文翻译】2019 年 FDA 新药审批总结报告
2020.01.11
美国 FDA 于 2020年 1 月 6 日发布了 2019 年度新药审批总结报告,报告汇总了 FDA 药品审评与研究中心(CDER)去年批准的所有新药、新用途和新适用人群,以及生物类似药、新配方和新剂型药物,概述了一系列值得注意的批准,提供了许多 CDER 批准的新治疗药物促进患者健康的有...
|

|
创新药 MAH 早期临床阶段需要什么程度的质量体系?
2020.01.10
MAH推进和创新药热潮,催生生产和检验完全外包的虚体药企。那么问题来了,这些企业在早期临床,具体来说就是临床I期,需要什么程度的质量体系呢?具体而言,需要多少个SOP呢?尤其是全生命周期GMP管理理念的盛行,可能产生两极分化,造成资源浪费和效率低下,甚至本末倒置 – 临床I期的...
|

|
服用二甲双胍后的体重降低可能是通过 GDF15 介导?
2020.01.10
二甲双胍是治疗II型糖尿病最常用的处方药,自上个世纪50年代就开始用于临床。近年来的研究表明,二甲双胍也可预防或延迟II型糖尿病的发病,高危人群服用二甲双胍的患者会出现体重降低、血糖和胰岛素水平降低以及胰岛素敏感性增强等作用,二甲双胍对于胰岛素增敏的机理已经较为明确,但是服...
|
|
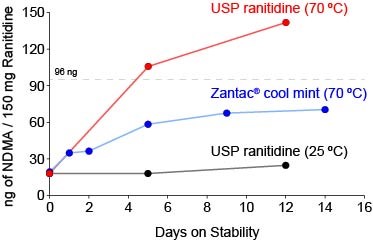
雷尼替丁亚硝胺杂质问题再升级,可在运输和贮存过程中...
2020.01.09
雷尼替丁中致癌性亚硝胺杂质问题再次升级,一家检测实验室向美国 FDA 提交公民请愿,表示经检测,即使药品在包装完好的状态下暴露在高温环境中,可疑致癌物 N-亚硝基二甲胺(NDMA)的含量也会增加,因此呼吁 FDA 召回所有雷尼替丁药物。
该检测实验室为位于加利福尼亚州 Alameda...
|

|
【转载】PNAS:让冷肿瘤变热,新型抗体组合有效清除肿...
2020.01.09
近年来,通过招募人体免疫细胞来破坏肿瘤组织的免疫疗法给癌症治疗带来了很大希望。一种能激活免疫细胞表面CD40受体从而刺激自然杀伤性T细胞产生的抗体在临床前研究中显示出强大潜力。然而,在随后的临床试验中,CD40抗体的成功率远低于预期,只有不到20%的患者产生应答。
知识卡:CD4...
|

|
FDA 批准帕博利珠单抗 (Keytruda) 用于卡介苗治...
2020.01.08
FDA approves pembrolizumab for BCG-unresponsive, high-risk non-muscle invasive bladder cancer
On January 8, 2020, the Food and Drug Administration approved pembrolizumab (KEYTRUDA, Merck & Co. Inc.) for the treatment of patients with Bacillus C...
|
|
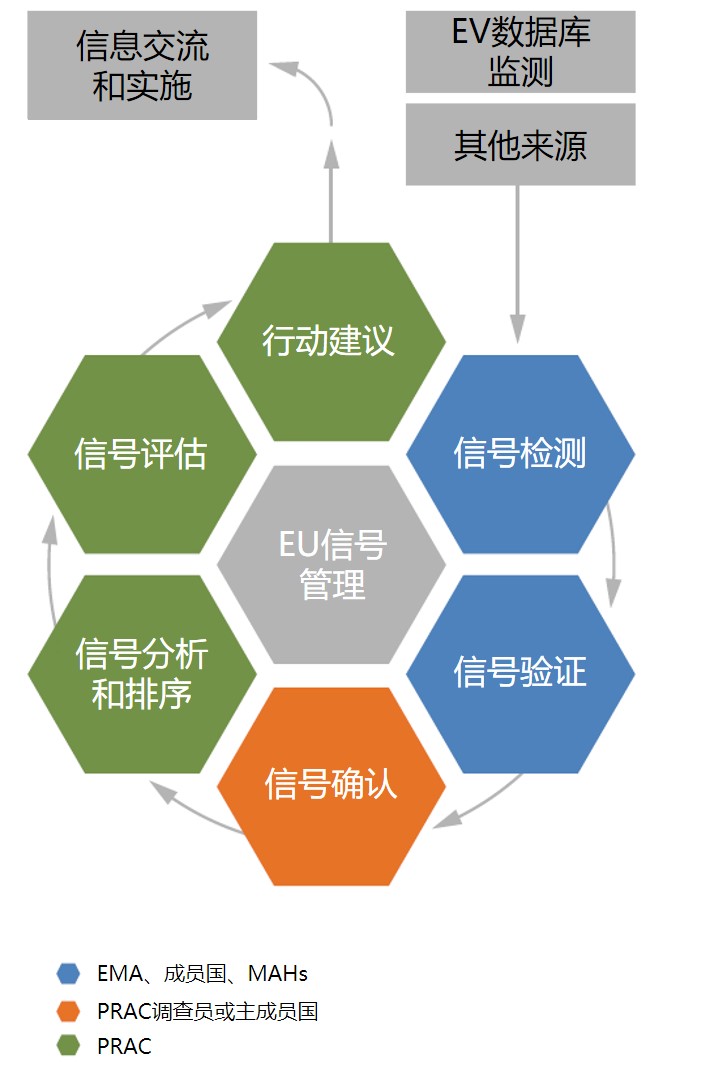
欧盟延长安全信号检测试点至 2021 年底
2020.01.08
安全信号是指新的或已知的可能由药物造成,并需进一步研究的不良事件的信息,它的来源包括:自发报告、临床研究、科学文献等。欧盟法规要求上市许可持有人(MAH)持续监测药物警戒系统数据,并向欧洲药品管理局(EMA)和成员国药监局报告检测到的经验证的安全信号。
欧盟的安全信号检测...
|

|
AI 系统可为乳腺钼靶影像的临床筛查提供高效辅助
2020.01.08
乳腺癌是导致女性罹患死亡的第二大癌症,早期诊断和及时治疗是提高患者生存率的最有效途径。目前,乳腺钼靶和超声诊断是早期筛查乳腺癌的主要手段,其中,钼靶对于非致密性乳腺的诊断准确性较高,而超声可以较为清晰的筛查出致密乳腺体内肿瘤。在欧美国家,医疗指南推荐所有女性从40岁或50...
|

|
FDA通过举办数据策略现代化公开会议来提高机构的科学...
2020.01.07
FDA continues to advance agency-wide scientific and technical capabilities by holding public meeting on modernization of data strategy
The following quote is attributed to FDA Commissioner Stephen M. Hahn, M.D.
“Data are the foundation of our most ...
|

|
零483代表什么 – 透过数据看合规
2020.01.07
注:在研究过程中,我们发现FDA提供的清单存在显著缺失,不少识林483数据库中已经收录的483并没有在其中体现,FDA对此备注说:并非所有的检查都收录在数据库里,不包括州检查、批准前检查、专论设施检查、等待最终执法行动的检查和非临床实验室检查。如果大家还发现有其它类型的缺失信息,...
|

|
【更新提示】识林一周回顾(20191229-20200105)
2020.01.06
【NMPA】国家药监局关于发布预防用疫苗临床试验不良事件分级标准指导原则的通告(12.31)
指导原则提供的疫苗临床试验不良事件的分级指标包括两部分,第一部分为临床观察指标,包括接种部位(局部)不良事件、生命体征和非接种部位(全身)不良事件;第二部分为实验室检测指标(包括血...
|