
|
管理临床实验室自研方法,FDA与CMS成立联合工作组寻求...
2015.04.19
对于针对实验室开发的测试(LDTs),是否进行与体外诊断产品(IVD)类似的上市前审评,是业界议论的焦点。
在拟定的LDT监管框架下,FDA旨在强化对部分LDT质量体系和上市前审评的要求。
医保与患者均希望临床所用的实验室测试方法稳定耐用、质量可靠。
FDA于去年10月份发布了一份指...
|

|
ANDA和505(b)(2)申请拟议规定专题-II
2015.04.18
ANDA 180天专营期的商业化上市触发
过去有两种方式可以触发ANDA的180天市场专营期规定 – 法院最终判决专利无效或专利不侵权或无法执行,以及发出PIV声明的ANDA产品在30个月停审期后首个商业化销售。现在,只有商业化销售可以触发。扭转为商业化销售的首个产品为Procardia XL的仿制药...
|

|
ANDA和505(b)(2)申请拟议规定专题-I
2015.04.17
节省邮资的拟议规定
FDA讨论了当ANDA或者505(b)(2)申请人提交第IV段声明后通知专利持有人和NDA持有人的时机。该法规过去要求自表明ANDA或者505(b)(2)申请已(分别)被接收或递交的函件“邮戳”日期算起的20日内发出通知。该表述实际要求FDA为这些信函付邮资,而其它所有的政府信...
|

|
2016财年GDUFA自我认定临近
2015.04.16
2015年4月15日,FDA Generic Drug User Fee Amendments of 2012 (GDUFA官网)更新一条红字信息“Fiscal year 2016 reporting period for self-identification opens May 1st to June 1st of 2015”,提示企业2016年财年自我认定报告期将从5月1日持续到6月1日。
...
|
|
百特部分静脉注射溶液因颗粒物问题被召回
2015.04.12
2015年4月9日FDA发布药品安全信息,百特国际公司因可能存在颗粒物自愿召回特定批次的医院/使用者级别的静脉注射(IV)溶液。含有无菌颗粒物的静脉注射溶液可能导致不良健康后果。不良后果的程度和严重性取决于外源物料的大小、数量和成分,以及患者的基本医疗条件。没有在线过滤的情况下...
|

|
三月 - FDA仿制药批准持续低迷
2015.04.08
4月7日显示FDA三月份的月度批准清单仅有14件批准和4件ANDA暂时批准。诚然,与庞大的积压相比,ANDA的数量正在下降,作为前FDA人员非常难以理解仿制药办公室(OGD)与Hatch-Waxman目标相关的关注点。我完全明白GDUFA目标是OGD绩效的要求,但如果ANDA没有获得最终批准,完全回应函和OGD在达...
|

|
数据可靠性与企业实践研讨会
2015.04.07
数据可靠性与企业实践研讨会
2015年6月22-23日
北京大学
“破坏数据可靠性就是欺骗行为” – FDA现场检查和国际事务副局长Howard Sklamberg
FDA近来加强了对数据可靠性的关注,尤其是对境外企业。过去两年中,FDA向15家印度企业发出了涉及数据可靠性的警告信(点...
|
|
【旧闻】一例重组生物制品处方变更引发的风波
2015.04.07
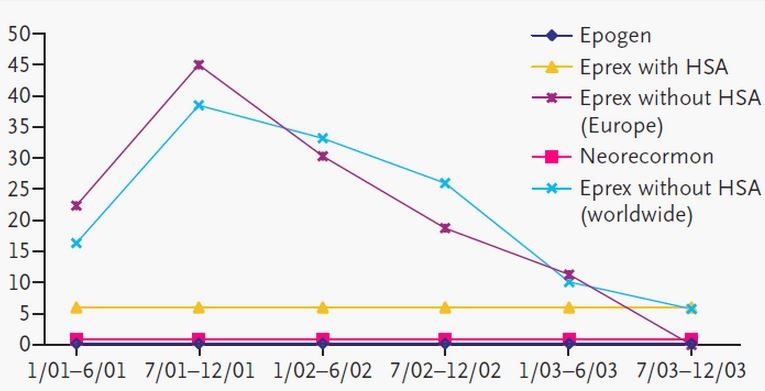
1998年,由抗EPO抗体诱发的纯红细胞再生障碍性贫血(PRCA)发生率突然升高,且大多发生在皮下注射Eprex(EPO alfa)的慢性肾损伤患者身上...In 1998, an increase in the incidence of pure red cell aplasia (PRCA) was observed that was associated with anti-erythropoieti...
|

|
FDA前局长出任医学研究所外务卿
2015.04.06
美国食品药品管理局前任局长Margaret A. (Peggy) Hamburg,已被任命为医学研究所(IOM)下一任外务卿,医学研究所是美国国家科学院的医疗卫生分支机构。在这个兼职的职位上,Hamburg将作为IOM主席和委员会的国际事务高级顾问,并作为国外医学和科学研究院的联络员。她的任期从4月6日...
|

|
2015卓越运营研讨会
2015.04.05
2015卓越运营研讨会
时间:2015年5月6日(周三)
地点:北京大学
我们诚挚地邀请管理者、生产管理者和OPEX负责人参加本次研讨会!
去年,Thomas Friedli教授和他的卓越运营(OPEX)团队在瑞士St. Gallen大学筹备了OPEX巡回研讨会,研讨会在德国杜塞尔多夫、美国芝加哥...
|

|
FDA中国办公室主任Chris Hickey博士讲座
2015.04.03
FDA中国办公室主任Chris Hickey博士讲座:食品药品安全 — 社会学与历史学视角
2015年4月2日,FDA中国办公室主任Chris Hickey博士来到北京大学为IPEM项目师生及北大在校学生做题为《食品药品安全:社会学与历史学视角》的讲座。
Hickey博士从法国社会学家爱米尔•涂尔干(Émile D...
|
|
EMA对GMP无菌生产附录的修订来到十字路口
2015.04.01
2015年2月5日, EMA, PIC/S发布了欧盟GMP指南附录1(无菌药品的生产)的修订概念文件草案,征求意见截止到2015年3月31日。预计将在10月份发布附录1草案,届时仍有6个月的时间来发表意见。附录1之前的修订分别在1996、2003、2007年,今年的修订将更为彻底。本次修订意在反映最近技术上...
|

|
药审中心提高BE判定标准与FDA接轨
2015.04.01
《化学药物制剂人体生物利用度和生物等效性研究技术指导原则》于2005年3月颁布,基于当时的历史情况,在生物等效性判定标准中对Cmax的要求为70%-143%。中国药典2010年版附录中《药物制剂人体生物利用度和生物等效性试验指导原则》将Cmax等效判定标准提高到75%-133%。我中心在近年来...
|

|
ANDA增补成为FDA仿制药行动中的又一大山
2015.03.31
2015年2月仿制药行动报告url,除了增补数量大幅度增加外,其它各方面数据看起来与之前各月的报告非常相像。
GDUFA YEAR/
Amendments
Oct-14
Nov-14
Dec-14
Jan-15
Feb-15
Originals (Pre FY15) Administrative
119
228
388
339
429
Originals (Pre FY15) Solicited (...
|

|
控制外源异物 USP与PDA新视角
2015.03.28
日前国内药监部门对齐都药业的严肃处理,引发了业界对可见异物问题的强烈关注。可见异物是注射剂的常见缺陷。在FDA公布的召回记录中,与可见异物以及不溶性微粒有关的记录多达60条。长期关注此话题的PDA,于2015年年初发文,认为在现行生产控制条件下,确实存在200微米以下的异物进入流通...
|

|
两大团体对FDA标签拟议的替代建议
2015.03.26
PhRMA(美国药品研究与制造商协会,Pharmaceutical Research and Manufacturers of America)和GPhA(仿制药协会,Generic Pharmaceutical Association)两大行业团体共同支持一份对于FDA拟议标签规定的替代建议—对安全性标签变更的“加速机构审评”(EAR)。
这两个行业团体认为...
|

|
从新泽西到新德里,质量的全球关注
2015.03.24
编者按:FDA总部CDER倡导质量量度、质量文化、“胡萝卜”加“大棒”、现场检查并非总是“找毛病来了”等新理念和做法已两年有余,但业界一直有人怀疑这些“高举高打”的倡议是否能被GMP现场检查员认可,当年PAT和QbD的倡议就是未被认可的先例。此篇文章中,FDA现场检查和国际合作方面的...
|

|
山东省局同意山东齐都药业恢复生产
2015.03.21
发布日期:2015-03-16 信息来源:药品生产监管处
针对山东齐都药业有限公司盐酸左氧氟沙星氯化钠注射液输液瓶出现异物的问题,按照监管部门要求,该公司于2015年2月13日全面停产整顿,深入查找风险隐患,细致分析问题发生原因和管理上存在的漏洞,采取有效措施,确保药品生产质量安...
|

|
北大IPEM“GMP企业实践”公开课
2015.03.20
北京大学药物信息与工程研究中心将于2015年4月3-5日开设“GMP企业实践”公开课,授课地点北大校内,授课人是曾负责拜耳公司原料药生产基地与GMP合规性相关工作的Bernd Schade(单博远)博士。单博士在药物制剂和原料药生产的质量保证、质量控制及技术操作等相关领域拥有超过28年的工...
|

|
FDA与印度药监机构合作进展
2015.03.19
Howard Sklamberg 和 Michael Taylor
FDA Voice 2015年3月18日
大约80%的原料药、40%的成品药、80%的海产品、50%的新鲜水果和20%的的新鲜蔬菜来自美国本土以外,这可能会令许多人感到惊讶,但这是事实。
每年,FDA需要评估数百万种植、收获、加工、制造并从美国以外运...
|