
|
【一周回顾】2021.04.26-05.02
2021.05.03
药审中心公开 ICH 指导原则实施情况宣讲会视频。PIC/S 发布更新的 GMP 指南,修订附录2,增加先进治疗产品的生产指南。美国 FDA 首次对未公开临床试验信息的企业采取罚款措施;发布个体化反义寡核苷酸治疗药物的非临床检测指南。WHO 发布监管决策中的良好信任实践和医疗产品良...
|

|
WHO 定稿良好监管实践和信赖指南,促进各国建立强有...
2021.05.03
世界卫生组织(WHO)最近发布了两份文件,对于加强各国监管体系活动至关重要,包括监管合作、趋同和透明度。
WHO 第 55 届药物制剂规范专家委员会(ECSPP)技术报告 1033(TRS 1033)中以附件 10 和 附件 11 的形式发布了有关良好监管实践(Good Regulatory Practices, GRP...
|

|
【周末杂谈】利益关系面前,谁也无能为力
2021.05.02
在临床试验信息公开事情上,看FDA是如何裹足不前的
2004年9月30日,美国默克公司畅销止痛药万络(Vioxx),因严重不良反应主动撤市,当天公司股票下跌27%,市值损失250亿美元。最终,因法律官司,公司赔付患者49亿美元、股东8.3亿美元,并被政府罚款9.5亿美元。这些都是众人皆知的事...
|

|
众监管机构讨论远程虚拟检查的期望和挑战,迫切希望回...
2021.05.01
美国 FDA 和欧洲药品管理局(EMA)的监管者们于 4 月 28 日在 ISPE 全球制药监管峰会上提供了有关桌面检查和虚拟检查的最新信息,并就如何确保更顺畅的检查提供了建议。
尽管监管机构似乎已经接受了在疫情期间执行虚拟检查和桌面检查的现实,但会上大量监管官员表示,现场检查更容...
|

|
PD-1 L1专家审查第二天:K药和T药膀胱癌适应症前景...
2021.04.30
美国 FDA 肿瘤药专家咨询委员会(ODAC)两个不同的专家小组于 4 月 28 日讨论了默沙东Keytruda(帕博利珠单抗,K药)和Genentech 的 Tecentriq(阿替利珠单抗,T药)各自关于膀胱癌适应症的加速批准。两个药尽管免疫疗法和适应症相似,但专家投票数却大不相同。
专家投票结果:...
|

|
FDA 对未能公开临床试验结果的企业发出首封不合规罚...
2021.04.30
美国 FDA 于 4 月 27 日对未能向联邦注册机构提交临床试验必要信息的申办人 Acceleron Pharma 发布不合规通知,威胁可能会处以罚款。这是 FDA 首次采取罚款措施来回应公众不断要求提高临床研究透明度的呼吁。
FDA 在信中指出,总部位于马萨诸塞州的制药商 Acceleron 公司...
|

|
FDA 发布个体化反义寡核苷酸治疗药的非临床研究指南
2021.04.29
美国 FDA 于 4 月 26 日发布了《针对严重衰弱或危及生命疾病的个体化反义寡核苷酸治疗药的非临床检测》指南草案,介绍了支持针对个体化反义寡核苷酸药物研究性新药申请(IND)的 FDA 建议的非临床信息。
FDA 代理局长 Janet Woodcock 表示,该指南的发布源于“为明确开发个...
|

|
罗氏阿替利珠单抗获 FDA 专家会支持保留加速批准适...
2021.04.29
美国 FDA 于 4 月 27 日组织召开的肿瘤药专家咨询委员会(ODAC)建议 FDA 保留罗氏 Genentech 的 PD-L1 抑制剂 Tecentriq(阿替利珠单抗)的三阴性乳腺癌加速批准适应症,等待进一步试验确证其临床获益。
尽管一些专家组成员认为,需要一项新的确证性试验来模仿 IMpassion1...
|
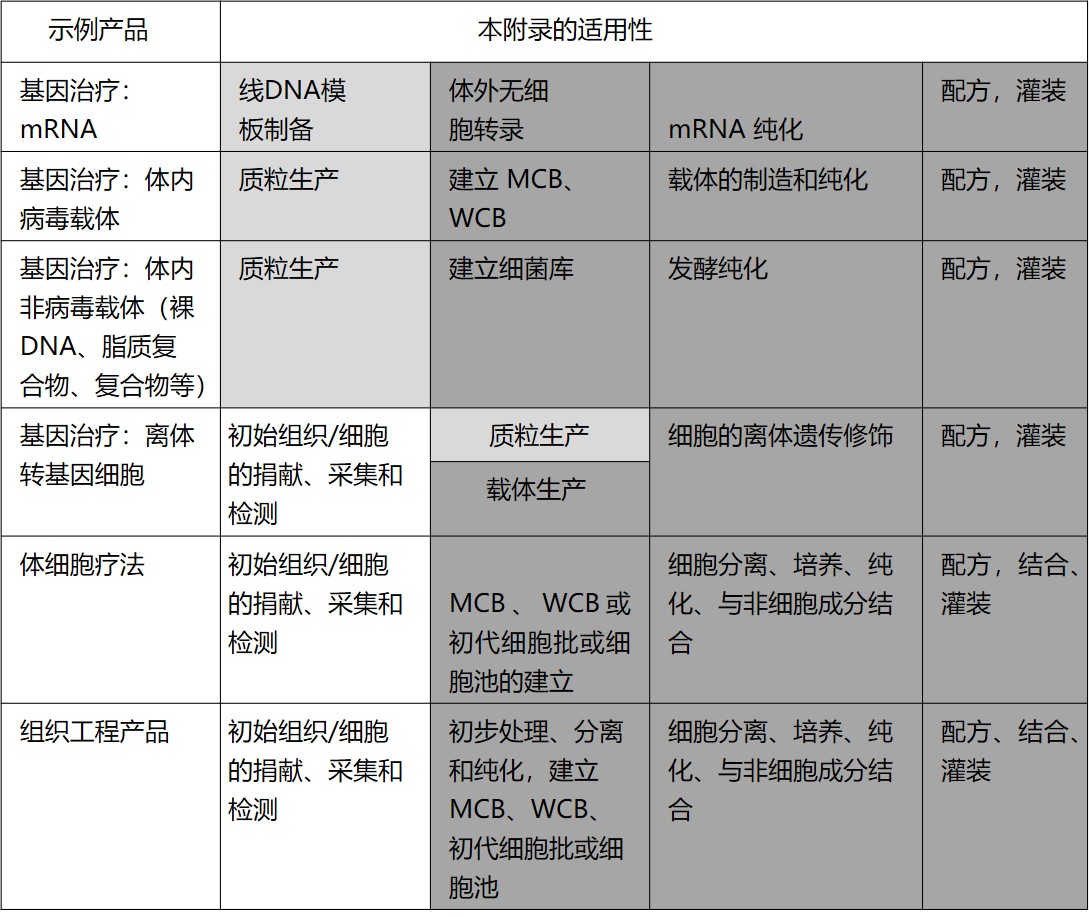
|
PICS 最新 GMP 指南增加附录 2A 先进治疗药品的...
2021.04.28
国际药品认证合作组织(PIC/S)于 4 月 26 日重新发布了其 GMP 指南,主要修订为将原 GMP 指南的附录 2 《人用生物原料药与药品的生产》稍作修订变为附录 2B,新增附录 2A《人用先进治疗医药产品的生产》。此次修订版本将于 2021 年 5 月 1 日生效。
在生产先进治疗医药产品(Adva...
|

|
韩国呼吁为新冠疫苗接种者提供全面赔偿机制
2021.04.27
韩国医学协会(KMA)敦促韩国卫生当局对被认为遭受新冠疫苗不良影响的人提供更积极、更全面的保护机制,而不是仅对因果关系明确的人提供补偿。
目前韩国一名 40 多岁护士助手的丈夫在接种阿斯利康新冠疫苗后被诊断出患有急性弥漫性脑脊髓炎,并表现出瘫痪症状,在接种疫苗后住院 19...
|

|
FDA 对再生医学疗法开启强制执法新时期,更严格监督...
2021.04.27
未获批准的细胞源性治疗产品的供应商将发现美国 FDA 即将终止对这些再生医学产品的执法自行裁量,转而开启强制执法新时期。
FDA 在 2017 年 11 月宣布其再生医学政策框架时,就开始了为期三年的执法自由裁量期计时。【FDA 宣布综合性再生医学政策框架 2017/11/18】去年夏天,F...
|

|
FDA 失去对器械或药品认定的灵活性,法院裁定造影剂...
2021.04.26
美国联邦哥伦比亚特区巡回上诉法院于 4 月 16 日在对 FDA 的裁决中确定放射性扫描期间使用的造影剂在法律上是一种器械而不是药物。如果 FDA 将产品作为医疗器械而不是需要 FDA 上市许可的药品进行监管,则对医疗产品制造商来说监管成本将大大降低。
这一裁决标志着 Genus ...
|

|
【一周回顾】2021.04.19-04.25
2021.04.26
美国 FDA 检查强生新冠疫苗 CMO Emergent 工厂并发布 483,同时公布了 Emergent 对 2020 年检查 483 的回复;FDA 和疾控中心安全审查后建议恢复使用强生新冠疫苗;FDA 撤销礼来新冠治疗性抗体 Bamlanivimab 的紧急使用授权。识林新增案例 ADC 药物的质量控制策略。药...
|

|
【周末杂谈】从数据角度看监管科学
2021.04.25
需要公开的、有助于科学评估具体监管手段效用的具体数据和资料
什么是监管科学?这个问题有些大,但不妨这样来想。物理化学是用化学的方法来研究物理,生物化学是用化学的方法来研究生物,药物化学是用化学的方法来研究药物构效关系。用这个逻辑,监管科学可以理解为用科学的方法来研究...
|

|
美国疾控中心建议恢复使用强生新冠疫苗
2021.04.24
美国疾病控制与预防中心(CDC)免疫实践咨询委员会于周五(4 月 23 日)下午投票得出结论,建议在美国恢复使用强生新冠疫苗。
此前由于接种强生疫苗后出现的六例严重血栓病例,美国 FDA 和 CDC 于 4 月 13 日共同建议暂停在美国使用强生新冠疫苗【美国因罕见血栓病例叫停强生新...
|

|
CMO混淆污染致1500万剂新冠疫苗报废:国会开始调查公...
2021.04.23
美国众议院两名高层民主党人正在调查污染千万剂强生新冠疫苗的 Emergent BioSolutions 是否以与关键特朗普政府官员的关系而赢得了联邦合同。
Emergent 可谓是掀起轩然大波,上个月底被曝出在生产强生和阿斯利康的新冠疫苗可能存在交叉污染问题,强生将此情况报告给了 FDA。【CMO混淆...
|

|
FDA飞速检查新冠疫苗CMO并发布长达12页的483
2021.04.22
美国 FDA 于 4 月 21 日(周三)公布了其对 Emergent Bio Solution 巴尔的摩工厂的检查 483,总共 12 页,9 大观察项。
此次 FDA 行动速度之迅速,自上个月底 Emergent 被曝出在生产强生和阿斯利康的新冠疫苗可能存在交叉污染问题,强生将此情况报告给了 FDA。【CMO混淆...
|

|
ICH 起草临床试验管理规范(GCP)指南现代化原则
2021.04.21
ICH 于 4 月 19 日发布了 E6(R3)临床试验管理规范(GCP)总体原则草案,这些原则将构成其修订 GCP 指南的基础。
ICH E6(R3) 专家工作组正在修订 E6(R2) GCP 指南,以期将 GCP 原则应用于越来越多样化的用以支持监管和医疗保健相关药品决策的试验类型和数据源,用...
|

|
CMO混淆污染致1500万剂新冠疫苗报废:FDA 关停工厂,...
2021.04.21
美国 FDA 要求 Emergent BioSolution 的巴尔的摩工厂停止生产新冠疫苗原液,并隔离所有剩余产品。
之前,该工厂由于同时生产强生和阿斯利康的新冠疫苗可能存在交叉污染而不得不废弃 1500 万剂强生疫苗原液。之后强生公司将事故报告给 FDA,FDA 对工厂生产线展开调查,同时强生...
|

|
FDA 代理局长谈卓越中心、疫情工作重点及加速批准审...
2021.04.20
首先需从疫情中恢复,不宜大刀阔斧改革
美国FDA 代理局长 Janet Woodcock 4 月 14 日在对更强 FDA 联盟(Alliance for a Stronger FDA)发表讲话时表示,当前的大环境不是在 FDA 进行大刀阔斧改革的合适时机,并讨论了 FDA 将如何使用其新获得的疫情资金以及对加速批...
|