
|
从最新加速审批撤销提议看 FDA 对程序完整性的解释
2020.10.07
美国 FDA 于 10 月 5 日提议撤销对 AMAG 制药公司早产预防药物 Makena(己酸羟孕酮)的批准,原因是上市后确证性试验失败以及加速审批程序的完整性。
FDA 药品审评与研究中心(CDER)表示,作为加速审批的条件所要求的确证性研究未能证实其临床获益,并且未证明 Makena 在...
|

|
欧盟已对两款候选新冠疫苗展开滚动审评
2020.10.07
欧洲药品管理局(EMA)于 10 月 6 日宣布已开始对第二个 COVID-19 候选疫苗进行滚动审评,该疫苗为 BioNTech 与辉瑞公司合作开发的 BNT162b2 疫苗。此前,EMA 于 10 月 1 日宣布了针对 阿斯利康与牛津大学合作开发的 AZD1222 疫苗的首个滚动审评。
EMA 表示人用药委员...
|

|
国际仿制药协会呼吁精简全球生物类似药开发和审批流程
2020.10.06
基于最新的科学进步和多年市场经验,国际仿制药和生物类似药协会(IGBA)在一份新的政策文件中倡导“改变生物类似药的开发范式”,以简化全球生物类似药的开发。IGBA 尤其指出比对疗效临床数据的价值,敦促在临床研究上更多地强调分析数据,不过这将需要重新花大力气教育行业利益相关者,...
|

|
FDA 实时审评计划或将扩大范围和程度
2020.10.06
美国 FDA 的技术现代化计划、基于云的申报功能扩展以及 COVID-19 大流行可能会成为促进 FDA 实时肿瘤学审评(RTOR)试点广泛推广的催化剂。
辉瑞公司法规政策和情报高级总监 Richard Jahn 在最近的 RAPS 年会上表示,FDA 肿瘤卓越中心的 RTOR 计划“极有可能”扩展到其它 ...
|

|
【一周回顾】2020.09.28-10.04
2020.10.05
识林发布冻干处方和工艺开发最佳实践案例分析。FDA 发布多篇研发、申报指南草案,包括口服药的 PBPK 分析,肾细胞以及膀胱癌的辅助治疗药品研发,暂时批准 ANDA 的增补和最终批准请求,ANDA 完全回应函延期回复,阿片类药物使用障碍等指南,并采纳了 ICH M7(R2) 和 E14/S7B ...
|
|
FDA 使用真实世界证据证实窄治疗指数仿制药的临床等...
2020.10.05
昨日的文章【周末杂谈:仿制药是无名英雄】介绍了仿制药花 20% 的钱干 90% 的事,既然仿制药如此优越,如何促进仿制药的使用呢?美国 FDA 一直以来不断强调仿制药的监管使用的是与品牌药一样严格的标准,但是患者和处方医生对药品质量的感知仍然对仿制药的临床应用有着很大影响。...
|

|
【周末杂谈】仿制药是无名英雄
2020.10.04
仿制药花20%的钱做90%的事,创新药花80%的钱做10%的事
这周三在美国国会听证会上,众议员Katie Porter质询Celgene药企总裁Mark Alles,有如下一段对话。
议员:你的畅销药Revlimid(瑞复美,治疗多发性骨髓瘤等疾病),2005年上市时一片卖 $215,2013年卖 $412,2017年卖 $7...
|

|
FDA 发布基于生理学的药代动力学(PBPK)分析指南草...
2020.10.03
美国 FDA 于 9 月 29 日发布《基于生理学的药代动力学分析的使用 — 用于口服药品开发、生产变更和控制的生物药剂学申请》指南草案,提供了有关研究用新药申请(IND)申办人、新药申请人和简化新药申请人在开发、评估和使用基于生理的药代动力学(PBPK)的一般性建议。
PBPK ...
|

|
七名前 FDA 局长联名呼吁美国政府停止对 FDA 信誉...
2020.10.02
继半个月前八名 FDA 现职专业负责人联名发表声明承诺基于科学的决策之后【FDA 专业负责人联名承诺:科学至上】,七名前任 FDA 局长于 9 月 29 日在《华盛顿邮报》的观点文章1中联名呼吁停止政府对 FDA 信誉的破坏。科学家应根据数据做出决策,不受政治压力或意识形态或既得利益...
|

|
2020 美国仿制药和生物类似药节约报告
2020.10.02
美国普享药协会(AAM)近日发布了《2020 仿制药和生物类似药可及性与节约报告》,概述了这些产品在 2019 年为美国消费者带来的节约。
AAM 作为仿制药行业协会,连续十多年来每年都会发布关于仿制药和生物类似药节约的报告,向立法者和公众汇报关于仿制药的一些关键数据。报告中的数...
|

|
FDA 暂时批准的 ANDA 如何及时获得最终批准?
2020.09.30
美国 FDA 于 9 月 28 日发布定稿指南《ANDA 递交 – 暂时批准 ANDA 的最终批准增补和请求》,指南为需要对暂时批准的仿制药进行 ANDA 增补的申办人提供建议,指南范围包括寻求最终批准的增补申请。
除了一些技术上的澄清外,该定稿指南总体上遵循了 2019 年 1 月的草案版...
|

|
英国 MHRA 发布指南对生物类似药比对研究要求减负
2020.09.30
英国药品与医疗保健产品监管机构(MHRA)发布了一篇生物类似药指南草案,旨在通过取消大多数情况下对于比对有效性试验的需求,减少对生物类似药提交的临床试验数据的需求。MHRA 提出,如果有足够的比对分析和功能性数据,通常就不认为需要进行比对有效性试验,因此对生物类似药的临床有效...
|

|
临床试验中关于人工智能干预措施的报告共识标准
2020.09.29
一项新的共识声明“CONSORT-AI 扩展”为涉及人工智能(AI)干预措施的临床试验报告制定了规则。CONSORT-AI 全称为合并的报告试验标准-人工智能(Consolidated Standards of Reporting Trials–Artificial Intelligence)扩展是一项新的报告指南,用于评估具有 AI 成分的干预措...
|

|
FDA 发布关于 ANDA 完全回应函延期回复的指南草案
2020.09.29
美国 FDA 于 9 月 28 日发布《在监管期限内未能回复 ANDA 完全回应函》的行业指南草案,旨在帮助提交简化新药申请(ANDA)申请人请求延长对 FDA 完全回应函(CRL)的回复。指南描述了 ANDA 申请人在 CRL 发布后必须采取的行动,以及如果申请人未能对 CRL 做出回复 FDA 可能...
|

|
【一周回顾】2020.09.21-09.27
2020.09.28
ICH Q3D(R2)新增附录 5 说明关于皮肤和透皮给药路径元素杂质限度的考虑。识林新收录 WHO 药品和疫苗预认证内容。欧盟发布基于患者登记的研究指南草案。药审中心征求境外已上市境内未上市化学药品药学研究与评价技术要求。FDA 要求苯二氮䓬类药物的标签变更;新增大麻二酚 BE ...
|
|
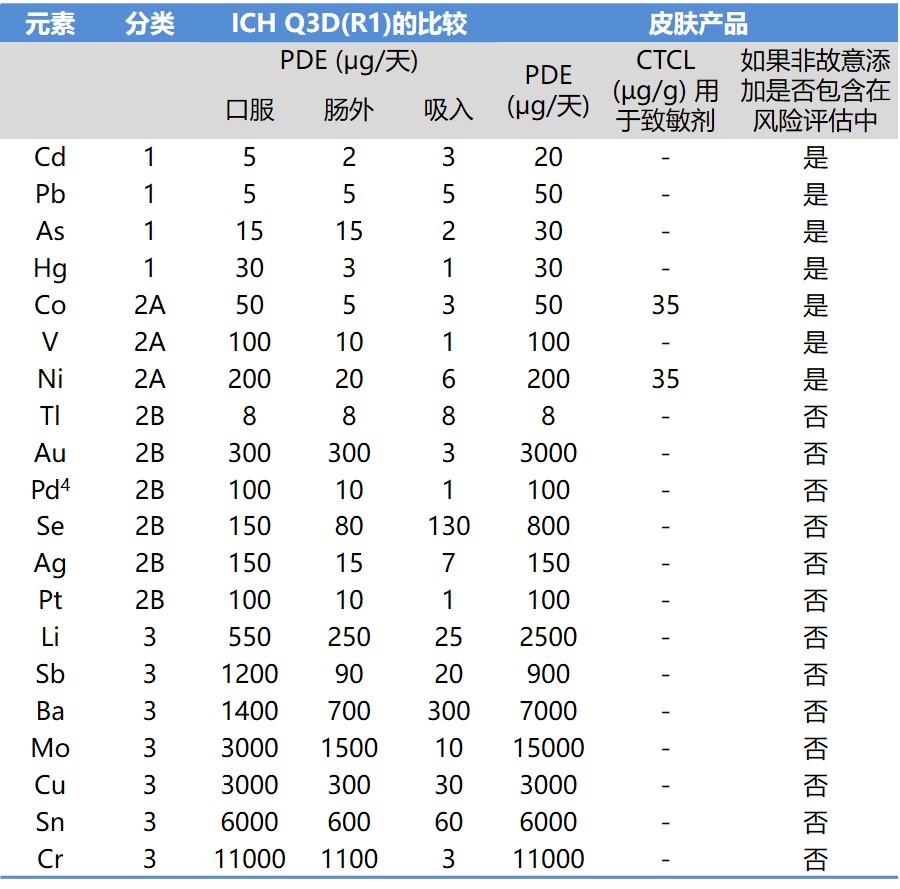
ICH Q3D 指南新增皮肤和透皮产品元素杂质限度附录
2020.09.28
ICH 于 9 月 25 日发布 Q3D 新附录 5 说明了关于皮肤和透皮给药路径元素杂质限度的考虑。附录介绍了如何通过将皮肤修饰因子(CMF)应用于每个元素杂质的肠外每日最大允许暴露量(PDE)来计算出所有相关元素杂质的皮肤 PDE。
附录适用于局部或全身作用的皮肤和透皮药品。不适...
|

|
【周末杂谈】规章的起草说明
2020.09.27
起草说明详述了FDA规章的来龙去脉和斟酌思考
这周三,FDA发布了两项拟议修订规章(21 CFR 201和801),澄清FDA是如何看待,因医生标签外用药或器械,企业是否要相应地修改产品标签【FDA 发布拟议法规澄清与标签外使用判定相关的证据】。这是个重要问题。众所周知,美国医生标签外用药...
|

|
欧盟发布基于患者登记的研究指南草案
2020.09.26
欧洲药品管理局(EMA)于 9 月 24 日发布有关基于患者登记的研究指南草案,为在药品许可前和许可后阶段使用患者登记提供了详细的建议。
基于患者登记的研究(Registry-based study)是一个或多个新的或现有登记库的基础结构对研究问题进行调查,以招募患者和收集数据。基于登记的...
|

|
FDA 发布拟议法规澄清与标签外使用判定相关的证据
2020.09.25
美国 FDA 在 9 月 23 日发布了一项新拟议法规,描述了在确定医药产品“预期用途(intended use)”时应考虑的证据类型。新法规将取消“整体证据”标准,并规定制药商对产品未获批用途的了解本身并不意味着该制药商打算将其用于该用途。拟议法规还提供了 FDA 在确定制药商是否打算...
|

|
如何避免瑞德西韦孤儿药认定的乌龙再次发生?
2020.09.25
不知大家是否还记得吉利德(Gilead)公司的瑞德西韦(remdesivir)曾短暂获得美国 FDA 孤儿药认定,但几天之后吉利德主动提出撤销请求。【众说纷纭:瑞德西韦孤儿药认定的授予与撤销请求 2020/03/26】这件事可能上了很有意义的一课,监管者需要更大的灵活性来管理孤儿药计划,包括之...
|