
|
EMA发布AI在药品生命周期中使用的思考性文件
2023.07.24
欧洲药品管理局(EMA)于 7 月 19 日发布了一份新思考性文件介绍了在整个产品生命周期和基于风险的背景下使用人工智能/机器学习(AI/ML)来开发和生产药物。思考性文件提供了有关 AI/ML 何时可用于开发产品以及如何在上市后环境中使用此类技术的见解。
该思考性文件由 EMA 大数...
|

|
【周末杂谈】生物药治疗慢阻肺的突破
2023.07.23
达必妥(Dupilumab)的临床研究,为慢阻肺药物的开发,树立了典范
三天前,美国《新英格兰医学杂志》发表了题为“达必妥治疗基于嗜酸性粒细胞计数的伴有2型炎症的慢阻肺,Dupilumab for COPD with Type 2 Inflammation Indicated by Eosinophil Counts”的研究型文章。研究结...
|

|
【轻松一刻】想合规都难?
2023.07.22
识林轻松一刻,意在以漫画形式,展现药企人酸甜苦辣,博得识林读者会心一笑之余,也希望带来些许回味与思索。
识林欢迎读者提供素材,可以是几段对话,也可以是一个故事。有合适的,识林会与您联系,一起优化完善,并由我们的设计师转化为漫画,在识林平台上分享给大...
|

|
“这个我也想问!”来识林社区GMP指南专栏畅所欲言
2023.07.22
历时18个月,识林和来自130余家企业的500余位专家一起,完成了4500页,近500万字的指南再版修订工作。编写小组经历了200多次,近千小时的深入研讨,深深认识到指南的工作没有结束,才刚刚开始。
识林社区为此专门开辟了GMP指南讨论专栏。这里不仅有指南的编写者,更欢迎指南的广大践...
|

|
辉瑞美国大型注射剂工厂遭龙卷风严重损坏,药品供应短...
2023.07.21
7 月 19 日,辉瑞位于美国北卡罗来纳州落基山市的一家主要生产工厂受到龙卷风的严重破坏。该工厂是世界最大的无菌注射剂生产厂之一。
据悉,辉瑞向美国医院销售的所有无菌注射剂中,有近 25% 来自该工厂。工厂建于 1968 年,辉瑞在 2015 年斥资 170 亿美元收购 Hospira ...
|
|
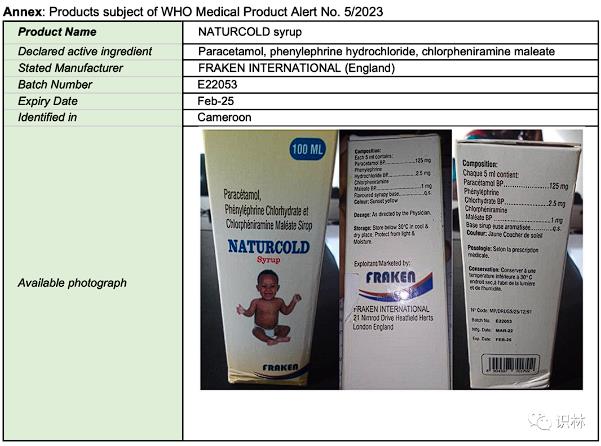
WHO 再次就非洲止咳糖浆污染问题发布产品警报
2023.07.21
WHO 于 7 月 19 日再次对在非洲发现的被二甘醇(DEG)污染的止咳糖浆发布医药产品警报。根据警报,具体产品名为 NATURCOLD 糖浆,今年 3 月份首次向 WHO 报告了这批受污染的产品,发现地为喀麦隆。
根据警报,NATURCOLD 所列出的活性成分包括乙酰氨基酚、盐酸去氧肾上腺素...
|

|
美国众议员22问FDA在印度和中国药品检查方面的进展
2023.07.20
美国众议院能源和商业(E&C)委员会三名共和党高层议员于 7 月 18 日致信 FDA 局长 Robert Califf,质疑 FDA 在解决印度和中国药品和原料药生产工厂问题方面的进展。信中共向 FDA 提出了 22 个问题,包括一般性检查问题、针对印度检查的问题,以及针对中国检查的问题。
...
|

|
欧盟委员会正加紧行动以预防今冬抗生素短缺
2023.07.20
欧盟委员会 7 月 17 日发布公告表示,将与主要利益相关者开会讨论避免即将到来的冬季抗生素短缺的措施。委员会建议无需不必要地使用或囤积这些抗生素,并要求制药商提高产量。
欧盟委员会、药品机构负责人(HMA)和欧洲药品管理局(EMA)建议监管机构、制药商和医疗保健提供者等利...
|

|
制药行业希望 FDA 延长对新型亚硝胺检测的最后截止...
2023.07.19
制药行业敦促美国 FDA 推迟关于 2023 年 10 月检测药品中新型亚硝胺的最后期限,表示鉴于缺乏有关这些杂质的毒理学数据,关于如何检测这些产品以及如何设定每日可接受限度仍然存在很大的科学不确定性。行业表示在这些问题得到解决之前,FDA 应推迟截止日期。
今年 5 月份 FDA...
|

|
FDA 完成对百济神州和诺华PD-1药物替雷利珠单抗的现...
2023.07.19
据报道,百济神州于 7 月 18 日上午在其投资者研发日发布会上宣布,美国 FDA 已完成对其 PD-1 抑制剂替雷利珠单抗(tislelizumab,品牌名:百泽安)的生产检查,上市申请(BLA)正在推进。
去年七月,根据百济神州和诺华的披露,由于新冠疫情带来的旅行限制,FDA 无法完成检...
|

|
国际药政每周概要:FDA细胞和基因治疗产品生产变更和...
2023.07.18
【监管综合】
【注册、审评、审批】
07.13【FDA】指南草案 人类细胞和基因治疗产品的生产变更和可比性
07.11【FDA】关于 FDA/EMA 复杂仿制药/混合产品并行科学建议计划的见解
【创新研发与临床】
07.13【FDA】指南草案 上市后研究和临床试验:确定不符合联邦食品、药...
|

|
FDA 公布 Catalent 工厂 483,导致再生元重磅药 Ey...
2023.07.18
美国 FDA 于 7 月 14 日公布了签发给 Catalent 印第安纳工厂的 483, 列举了三大观察项。这些检查缺陷导致再生元(Regeneron)重磅药物 Eylea(aflibercept)新版本的上市申请遭拒。
再生元上个月宣布,由于正在对印第安纳州 Catalent 工厂检查发现进行审查,FDA 未批准 8mg 版...
|

|
我国药企常见的工艺验证检查缺陷和问题梳理
2023.07.17
以下文章来源于IPEM ,作者IPEM
工艺验证在GMP 中的重要地位决定了其必然会成为全球各类药品检查的主要内容。事实上,在药品检查工作中,药品工艺验证也是发现问题较为集中的部分。国家局核查中心的几位检查员在2021年发布的《工艺验证检查缺陷分析》1一文中,对我国境内约300 家药...
|

|
国内药政每周导读:CDE临床期间安评,临床药物性肝损...
2023.07.17
【创新药与临床研究】
7.10,【CDE】发布《临床试验中的药物性肝损伤识别、处理及评价指导原则》的通告(2023年第39号)
7.10,【CDE】关于公开征求《药品审评中心药物临床试验期间安全信息评估与风险管理工作程序(试行)修订稿(征求意见稿)》意见的通知
7.11,【CDE】...
|
|
【周末杂谈】学者们为仿制药站队
2023.07.16
用专业实证的方法来堵美国政府医保限价政策的漏洞
计划经济下的政府医保做起事来名正言顺、大刀阔斧。在美国则不然。虽然政府为支持利国利民的仿制药发展,颁布仿制药法已长达39年,但由于品牌药企业的百般阻挠,仿制药仍面临种种困难。其一就是法律禁止政府医保(Medicare)与品牌药企...
|

|
【识林主题词】新增:溶瘤病毒,预防性维护,反渗透;...
2023.07.15
— 主题词,是识林针对制药行业的关键概念,基于大量资料的综合分析,从定义、工作流程、法规指南、文献案例等多个维度梳理的系统知识纲要。截至目前,识林【主题词库】已上线超过1000个主题词,还在陆续增补当中。
— 从主题词入手,也是使用识林的最佳方式之一。主题词的系统性、全...
|

|
【识林新解读】QA岗位从业心得,新加坡监管体系索引,...
2023.07.15
在汇集官方法规指南之余,识林或原创、或搜集整理了大量对比解读、案例解析等内容,作为识林用户的参考资料,从而提供更多视角,且与岗位实务联系更为紧密。
这类资料,全部收录在专门为此开发的“对比解读案例解析”数据库内,通过“业务标签”和“知识标签”的交叉索引,便于用户迅速...
|
|
FDA 发布细胞和基因治疗产品生产变更和可比性指南草...
2023.07.14
美国 FDA 于 7 月 13 日发布了《人类细胞和基因治疗产品的生产变更和可比性》指南草案,提供了 FDA 对基于生命周期方法的细胞和基因治疗(CGT)产品生产变更的管理和报告以及评估生产变更对产品质量影响的可比性研究的当前思考。
由于 CGT 产品的复杂性,对生产变更的管理带来了...
|

|
FDA 收到的含人工智能和机器学习的药品申请数量激增
2023.07.14
美国 FDA 药品审评与研究中心(CDER)定量药理学处处长 Hao Zhu 上个月在 DIA 全球年会上表示,结合人工智能和机器学习(AI/ML)元素的药物申请数量在过去五年内急剧增加。
他表示,2022 年 FDA 收到了 170 件包含 AI/ML 的申报材料。而 2018 年只有 3 份申报内容包含 A...
|

|
FDA 探索使用患者报告的结果(PRO)测量多发性骨髓瘤...
2023.07.13
美国 FDA 最近发布了一项研究,探讨使用患者报告结果(PRO)来评估多发性骨髓瘤患者的衰弱程度,以期直接从患者那里获得关于患者体验的科学信息。
衰弱(frailty)是一种与衰老相关的身体和生理功能下降综合征,包括虚弱和疲劳,更多并发症以及对药物治疗耐受性降低等症状。肿瘤患者...
|