|
FDA 关于 Moderna 新冠疫苗紧急使用授权的专家会资...
2020.12.18
美国 FDA 于 12 月 17 日召开疫苗与相关生物制品专家委员会(Advisory Committee)会议讨论 Moderna 的新冠(COVID-19)疫苗 mRNA-1273 的有效性和安全性是否足以支持紧急使用授权(EUA)。会议表决结果为:20 赞成,0 反对,1 弃权。有关会议讨论的详细报道请见【快讯】Mode...
|
|
【快讯】Moderna 新冠疫苗专家会意见,20-0 支持紧...
2020.12.18
北京时间 12 月 18 日早 6 点 10 分,美国 FDA 就 Moderna 新冠(COVID-19)疫苗 mRNA-1273 的紧急使用授权(EUA)召开的专家会刚刚结束。在结束了一整天 8 个多小时对 Moderna 新冠疫苗的广泛讨论后,外部专家以 20 赞成,0 反对,1 弃权,认为基于可用全部科学证据,Moder...
|
|
欧盟新冠疫苗专家投票日期提前,使用附条件批准路径
2020.12.17
欧洲药品管理局(EMA)迫于政治压力预期将在下周就首个新冠(COVID-19)疫苗给出附条件上市批准建议。
EMA 之前计划“最迟”在 12 月 29 日之前就辉瑞/BioNTech 的 COVID-19 疫苗 BNT162b2 做出决定,但现在将这一决定提前至 12 月 21 日。EMA 专家的预期投票结果将...
|
|
Moderna 新冠疫苗专家会会前资料,非常有效但不良反...
2020.12.16
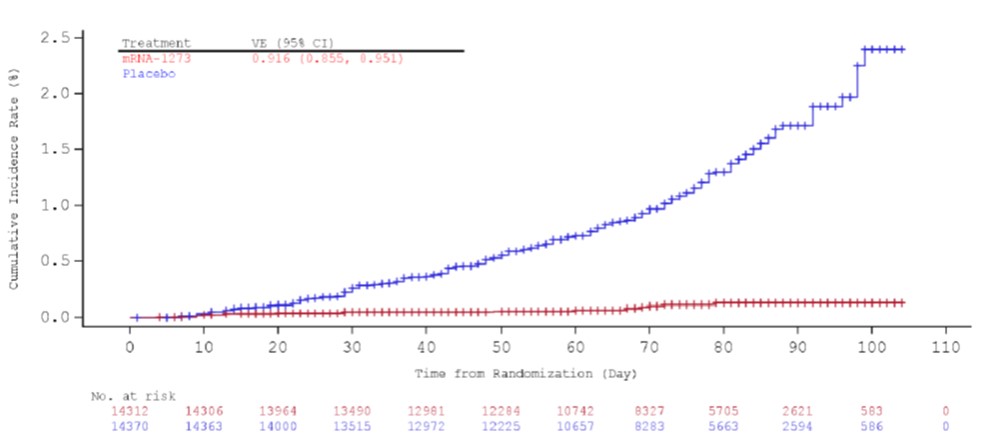
美国 FDA 于周二(12月15日)发布了针对 Moderna 新冠(COVID-19)疫苗紧急使用授权(EUA)的专家咨询委员会(advisory committee)的部分会前资料,FDA 审评科学家认为该疫苗安全有效。
在计划于本周四召开的疫苗和相关生物制品咨询委员会会议上,外部专家将投票表决 Moderna COVI...
|

|
EMA 新冠疫苗数据被黑客攻击,冷链组织或也受到网络...
2020.12.11
欧洲药品管理局(EMA)于 12 月 9 日在其网站上发布了一条简短的通知,透露 EMA 遭到网络攻击,但没有关于攻击程度的任何细节。但德国疫苗开发商 BioNTech 发表声明表示,其与辉瑞公司合作开发的新冠(COVID-19)疫苗 BNT162b2 有关的提交到监管机构的文件存储在 EMA 服务器...
|
|
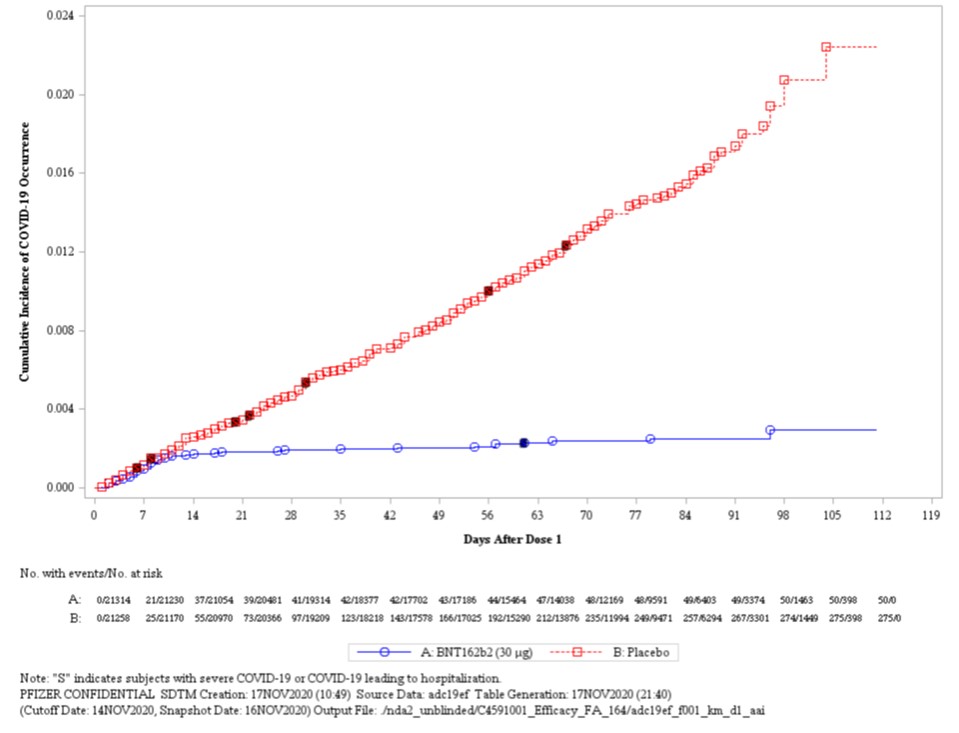
【快讯】辉瑞新冠疫苗专家会意见,17-4 赞成紧急使...
2020.12.11
截至发稿前 20 分钟(北京时间 12 月 11 日早上 6:40),美国 FDA 关于辉瑞-BioNTech 的新冠(COVID-19)mRNA 疫苗 BNT162b2 召开的专家会刚刚结束。
经过 8 个多小时的数据演示、问答、讨论和辩论,外部专家们就“基于现有的全部科学证据,辉瑞-BioNTech COVID-19...
|
|
FDA 疫苗专家会会前资料公布,认为辉瑞新冠疫苗非常...
2020.12.09
美国 FDA 在周二(12 月 8 日)发布的疫苗专家咨询委员会(advisory Committee)会前资料中认可了辉瑞和 BioNTech 的新冠(COVID-19)疫苗 BNT162b2 的有效性和安全性。
这些文件是即将在本周四举行的疫苗外部专家会议的背景材料,此次专家会颇受关注,被视为是 FDA 颁发首个 C...
|

|
柳叶刀发表阿斯利康新冠疫苗详细数据,具有中等保护效...
2020.12.09
牛津大学和阿斯利康正在开发的新冠(COVID-19)疫苗在预防有症状性疾病方面似乎具有中等效力,并且可能会大大减少疾病的住院率。
《柳叶刀》(The Lancet)于 12 月 8 日发表了牛津/阿斯利康 COVID-19 疫苗 ChAdOx1 的新数据1,该数据来自不同阶段的试验,并包含超过 20,0...
|

|
【周末杂谈】疫苗与全球化
2020.12.06
科学和全球化是新冠疫苗快速问世的原因,不是民族主义
在盛行国家主义、推崇美国至上、呼吁制造回归、攻击全球供应链的气氛下,这周四美国理性杂志(Reason)记者Eric Boehm将疫苗的快速问世归功于科学、医学知识和全球化。文章颇有特色。现摘录翻译编辑部分如下。
副总统彭思周四...
|

|
辉瑞和 Moderna 面临压力和批评,未承诺向发展中国...
2020.12.04
辉瑞/BioNTech 和 Moderna 有望在 2020 年底之前在美国和欧洲获得新冠(COVID-19)疫苗紧急使用授权,但发展中国家要获得其第一批疫苗可能要等上几个月的时间。
辉瑞/BioNTech 的 BNT162b2 刚刚在英国获得首个紧急使用授权,同时也有望在不久后获得美国和欧盟的授权。Moderna...
|
|
英国率先授权辉瑞新冠疫苗,欧盟和美国怎么看?
2020.12.03
北京时间 12 月 2 日晚的热门新闻之一恐怕是英国通过特殊立法程序临时批准使用辉瑞/BioNTech 的 BNT-162b2 疫苗了,这一批准标志该疫苗成为首个获准广泛分发的 mRNA 疫苗。
英国卫生和社会保障部表示,此次临时批准是在“几个月严格临床试验和由英国 MHRA 专家对数据进行...
|

|
阿斯利康新冠疫苗申请放弃高保护效力数据,英国开始滚...
2020.11.30
阿斯利康和牛津大学宣布将采用较低保护效力(62%)的一组数据,放弃使用争议颇大的高保护效力(90%)数据向监管机构递交申请,以期获得快速或附条件批准。英国 MHRA 已开始滚动审评,美国 FDA 可能不会接受这一数据。
上周阿斯利康和牛津大学公布了其候选新冠(COVID-19)疫苗 AZD...
|

|
阿斯利康新冠疫苗初步分析平均百分之七十效力,对供应...
2020.11.24
两种接种方案,保护效力分别为 90% 和 62%。
阿斯利康于北京时间 11 月 23 日下午宣布,根据在英国和巴西进行的大型三期试验的期中分析,其新冠(COVID-19)候选疫苗 AZD1222 平均可降低 70% 的有症状 COVID-19 风险。
虽然结果是积极的,但该疫苗可能不如前不久公布结果的辉瑞...
|

|
欧盟发布新冠疫苗批准考量,欧美将相继于下月直播疫苗...
2020.11.23
欧洲药品管理局(EMA)于 11 月 19 日发布对新冠(COVID-19)疫苗批准的思考,讨论了 EMA 对上市许可(MA)申请中临床、有效性、安全性以及上市后随访的要求。欧洲 EMA 和美国 FDA 将于北京时间 12 月 11 日前后分别召开 COVID-19 疫苗公开会议。
EMA 关于新冠疫苗批准...
|

|
辉瑞新冠疫苗完成有效性分析,不日将提交紧急使用申请
2020.11.19
辉瑞和 BioNTech 于本周三宣布,其新冠(COVID-19)候选疫苗试验有效性分析已经完成,数据表明该疫苗具有 95% 的保护效力。两家公司表示计划在“几天之内”向美国 FDA 提交紧急使用授权(EUA)申请,并将向全球监管机构提交申请。
上周一辉瑞和 BioNTech 宣布研究的早期分析...
|

|
Moderna 宣布新冠疫苗保护效力达百分之九十四,或可...
2020.11.17
Moderna 公司于美国时间本周一早上宣布,其疫苗在预防新冠(COVID-19)方面的保护效力为 94.5%,与辉瑞/BioNTech 上周对自己的疫苗宣布的结果相当或略胜一筹。辉瑞公司上周表示,他们的疫苗保护效力“超过 90%”。【辉瑞新冠疫苗III期期中分析显示 90% 保护力,后续可期待些什么?】...
|

|
辉瑞新冠疫苗III期期中分析显示百分之九十保护力,后...
2020.11.10
94 例感染病例,数据和关键信息尚不可得,本月下旬或提交 EUA。
美国辉瑞和德国 BioNTech 于美国时间本周一早晨表示,他们的新冠(COVID-19)候选疫苗非常有效,超出预期。该疫苗是首个在美国进行大规模 III 期试验产生后期数据的疫苗。两家公司表示,对结果的早期分析显示,相...
|
|
欧洲药品管理局将不会为新冠候选疫苗设定最低保护效力...
2020.11.06
根据路透社消息,欧洲药品管理局(EMA)于昨日表示,在考虑批准潜在的 COVID-19 疫苗时,不会设定最低保护效力标准,这与美国 FDA 目前采取的做法不同。
EMA 在一封电子邮件中表示,人体研究需要证明令人信服的保护效力水平,但是一个疫苗是否被认为是可接受的将根据所有关于安全...
|

|
FDA 紧急使用授权程序正逐步改善,应更加透明
2020.11.04
美国 FDA 从早期 COVID-19 紧急使用授权(EUA)中吸取的经验教训可能会大大提高公众对未来治疗药 EUA 或疫苗 EUA 以及监管程序本身的信任。美国达特茅斯学院政府学系研究药物监管政策的 Herschel Nachlis 在卫生事务博客上发文1,总结了从 FDA 康复期血浆 EUA、COVID-19 ...
|
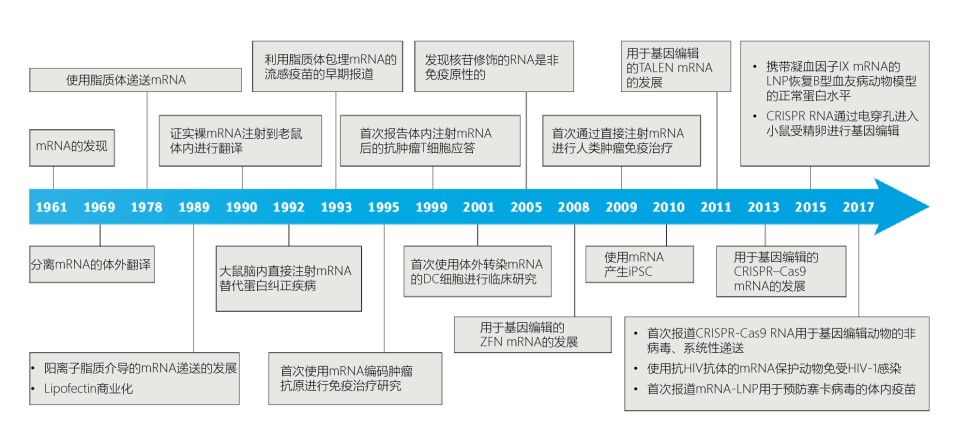
|
从新冠候选疫苗 BNT162b 看 mRNA 疫苗
2020.11.03
欧盟药品管理局(EMA)于10月6日宣布,基于BNT162b2的非临床和早期临床初步结果,对辉瑞/Biontech的候选新冠疫苗展开滚动审评,这是EMA第2个开展滚动审评的新冠疫苗,上一个是阿斯利康与牛津大学合作开发的AZD1222疫苗。CHMP已开始审评关于疫苗的非临床实验数据1。辉瑞之前曾表示最早10月...
|