|
FDA 2021 财年仿制药批准数据趋势与分析
2021.11.09
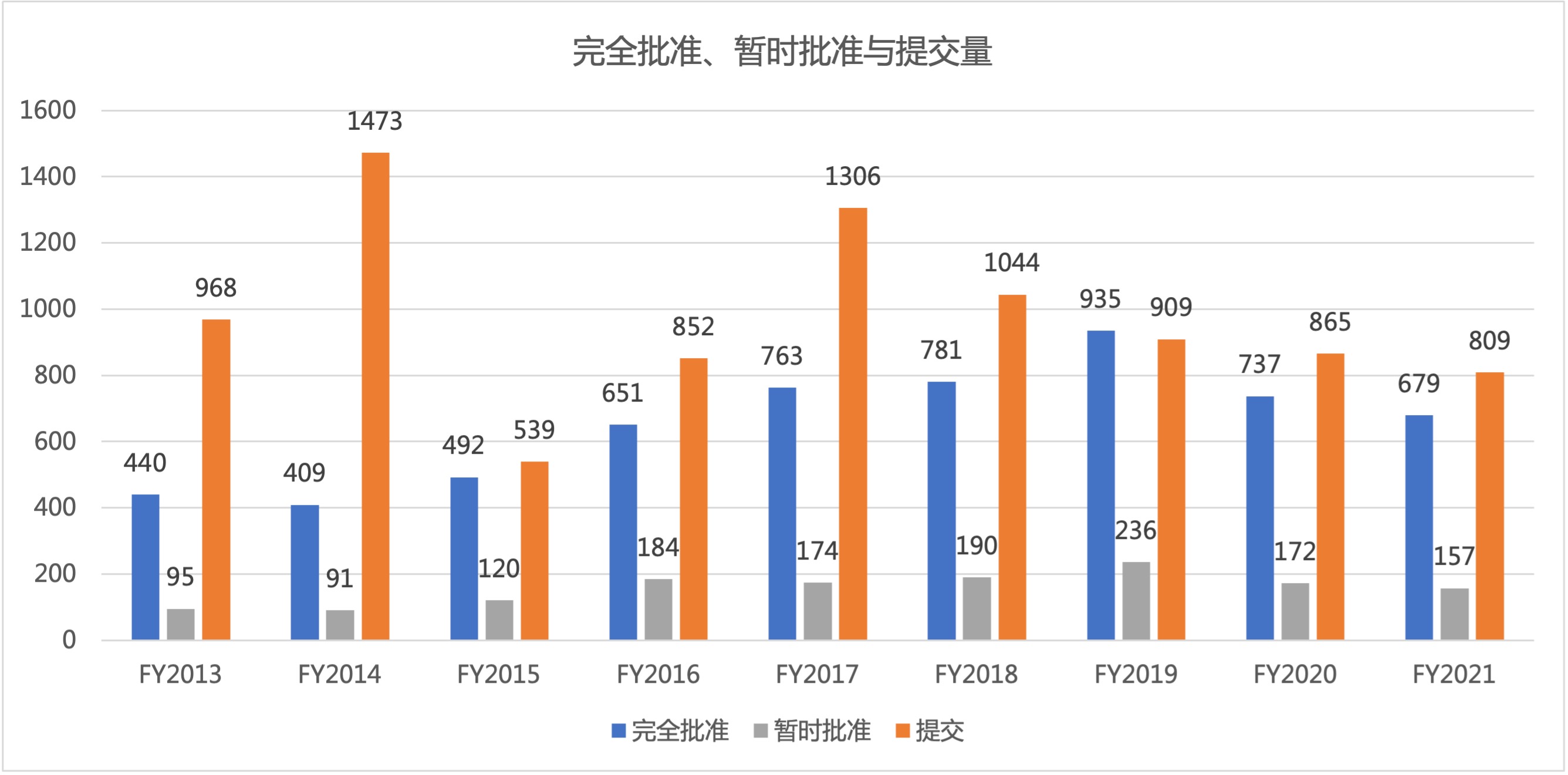
美国 FDA 仿制药办公室(OGD)公布了 2021 财年全部仿制药使用者付费(GDUFA)批准数据。2021 财年 FDA 报告了 679 件完全批准,这是自 2016 财年(650 件批准)以来最低的年度总数(见图 1)。2021 财年的批准总数比 2020 财年减少 58 件,比 2019 财年(935 件,创...
|

|
FDA 2020 财年仿制药批准量下降,已达稳态?
2020.10.21
2020 财年已经结束,美国 FDA 仿制药使用者付费(GDUFA)的部分批准数据也已出炉。2020 年 FDA 报告了 737 件简化新药申请(ANDA)批准,这是自 2016 财年(650 件批准)以来最低的年度总数(见表 1)。2020 财年批准总数比 2019 财年减少了近 200 件,去年 FDA 创造了...
|
|
FDA 仿制药积压已清理,批准神话难持续?
2019.12.09
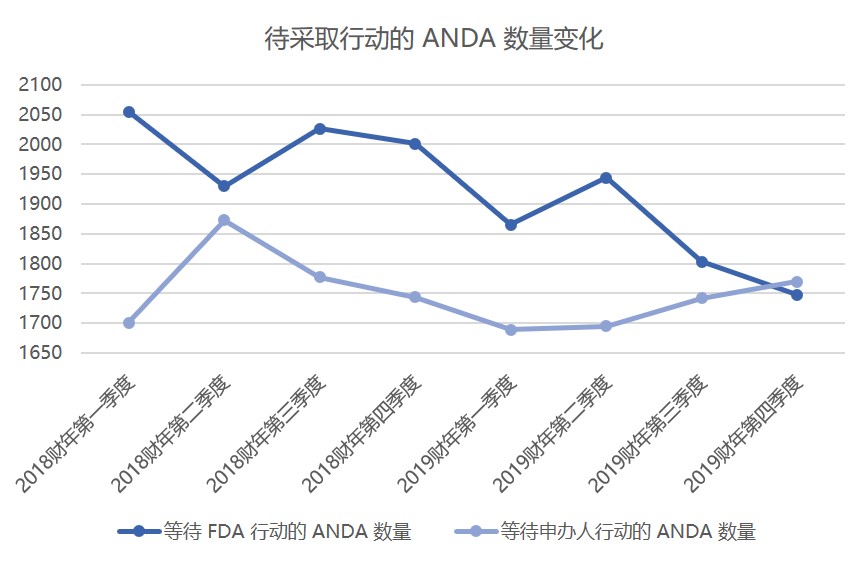
美国 FDA 药品审评与研究中心(CDER)主任 Janet Woodcock 表示,近年来 FDA 接连创下仿制药批准数量记录的部分原因是大量申请积压。因此,由于 FDA 批准了现有积压的剩余部分,因此“可能不会保持”创纪录的年度仿制药批准。
Woodcock 于 12 月 3 日在 FDA/CMS 年会上表...
|

|
FDA 2019 财年仿制药批准破 900,批准量首超提交量
2019.10.19
2019 财年已经结束,自美国仿制药使用者付费计划(GDUFA)实施以来,这是 ANDA 批准行动数量首次超过提交数量(935 件批准,909 件新 ANDA 提交)。此外,FDA 仿制药办公室(OGD) 2019 财年以 935 件批准的成绩再次打破了批准记录,比 2018 财年 的 781 件批准多出 154 件(...
|
|
FDA 仿制药批准再创纪录,但问题依旧
2019.08.19
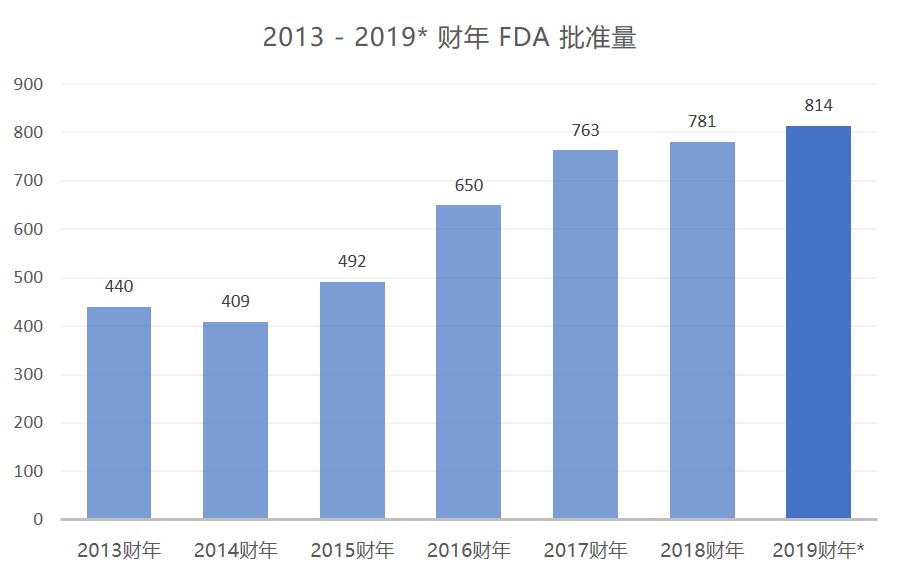
美国 FDA 继续保持其仿制药批准大踏步前进,距财年结束还有两个月的时间,批准量已创历史新高。
FDA 在 7 月份公布了 61 件 ANDA 完全批准后,本财年前 10 个月的批准总数已达 814 件,首次突破 800 并打破了 2018 财年 781 件完全批准的记录。按照此速度,FDA 在本财年...
|

|
美国政府重新开张后 FDA 可能面临仿制药审评危机?
2019.01.21
我们之前曾在一篇文章中简单讨论过美国政府关闭对于 FDA 整体上的影响:【联邦政府关闭对 FDA 的影响】。今天我们看看仿制药界资深人士 Bob Pollock 先生根据其多年来对行业和 FDA 仿制药工作的了解,对于政府重新开张后 FDA 可能面临的一些麻烦的预判:
FDA 仿制药办公室(O...
|

|
FDA 2018 财年仿制药批准再创纪录
2018.10.16
美国 FDA 仿制药办公室(OGD)2018 财年批准了 781 件 ANDA,打破了 2017 财年 763 件批准的历史记录,同时还有 190 件暂时批准,共 971 件批准,也创下了新的批准记录。这是一个好迹象,表明随着 GDUFA II 期第一个财年的结束,仿制药批准工作正在朝着积极的方向发展。
FD...
|

|
FDA 2017财年3月ANDA提交量激增的猜想
2017.04.30
美国 FDA 3 月份仿制药申请提交量再次飙升,共收到 197 件 ANDA 申请,比 1 月和 2 月的提交量显著增加(这两个月每个月的提交量都不到 60 件)。这是自 2012 年 10 月 仿制药使用者付费(GDUFA)计划推出以来提交量第 4 高的月份。
提交量剧增的原因似乎难以捉摸。这...
|

|
FDA 2017财年2月ANDA批准和接收数据
2017.03.18
美国 FDA 仿制药办公室(OGD) 2017 年 2 月份共批准 61 件 ANDA,非常接近月度新药和仿制药批准网站报告的 60 件的数量。这是过去许多月份中看到的批准量差异最小的一个月。OGD 还发布了 11 件暂时批准(TA),故 2 月份共有 72 件批准行动。如果依据本财年过去五个月的批...
|

|
FDA 2017财年1月ANDA批准和接收数据
2017.02.10
美国FDA官网上有多个报告页面可以查看仿制药的批准情况,但是不同报告的一致性却总是差强人意。旧的FDA月度批准报告从来没有提供过与OGD在其仿制药计划行动报告(行动报告)中公布的相一致的数据。这两份报告之间的批准量通常有5-10%的差异。几个月前FDA开始在其新药和仿制药批准页面上...
|

|
2016年年末FDA仿制药提交量激增
2017.01.11
随着2016年年末更多仿制药申请提交,美国FDA仿制药办公室(OGD)工作人员可能会为达到审评目标而度过一段较为艰苦的时期。仿制药工作量在12月的大幅增加可能为FDA加强后的审评体系和批准速度提供各种压力测试。
12月共有235件简化新药申请(ANDA),这是自2014年6月因稳定性要求变化而收...
|

|
FDA 2017财年11月ANDA批准和接收数据
2016.12.13
2017财年11月的ANDA批准量和接收量以及其它一些早期统计数据已经公布,这些数据有点令人不安。虽然FDA 11月批准的ANDA比10月稍多,59比54,但也接收了81件新ANDA。
Activities Report of the Generic Drug Program
当我们审视2017财年批准和接收量的早期预测时(我们现在仅有...
|

|
FDA 2017财年首月ANDA批准和接收数据
2016.11.18
2017财年第一个月的仿制药数据与2016财年的大多数月份相同。FDA仿制药办公室(OGD)完全批准54件ANDA,暂时批准16件ANDA,作为GDUFA第五年的开端共计70件批准行动。完全回应函保持在151封,再次与去年的平均量一致。
Activities Report of the Generic Drug Program
令人震惊...
|

|
2016财年FDA ANDA批准和接收数据已公布
2016.10.13
FDA仿制药办公室(OGD)于10月11日发布了2016全财年的批准和接收数据以及一些其它指标。9月份OGD批准的51件ANDA,2016财年总批准量为651件,平均每月54.25件。这至少是过去8年(也许更长时间)在一财年中批准量最高的年份,并且是GDUFA I期批准量最多的一年(之前最高的是2015财年的492件...
|

|
FDA 2016财年8月ANDA批准数据
2016.09.17
FDA仿制药办公室(OGD)8月完全批准51件ANDA,暂时批准14件,总共65件批准行动。本月共接受59件新原始ANDA,低于本财年的月平均接收量72件(但请注意是由于本财年有两个月接收量拉高了平均值,12月180件和3月114件)。
Activities Report of the Generic Drug Program (FY 201...
|

|
FDA 2016财年7月ANDA批准数据
2016.08.16
FDA仿制药办公室(OGD)已发布其7月份的ANDA批准和接收数据。本财年到目前为止,OGD共批准548件原始ANDA,月平均批准54.8件。OGD表示批准量各个月有高有低,7月份批准46件ANDA成为本财年次低的月份(最低的是2016年1月,只有43件批准)。此外,7月份也是暂时批准量次低的月份,共10件暂时...
|

|
FDA 2016财年6月ANDA批准数据
2016.07.12
6月FDA共批准66件ANDA,其中51件完全批准(比GDUFA第4年到目前为止的月平均批准量略低)和15件暂时批准(TA)。6月接收量回升到79件,仅次于12月180件和3月114件的接收量,排名本财年第三。本财年到目前为止共502件完全批准,144件暂时批准,665件新接收ANDA。
2016财年已拥有9个月的数...
|

|
FDA 2016财年5月ANDA批准数据
2016.06.08
仿制药办公室(OGD)5月完全批准54件ANDA,暂时批准20件。5月原始ANDA的接收量为58件,本财年只有三个月的接收量高出这一数字。
使用目前8个月批准总量的平均值估计2016财年可能总共批准676件ANDA,比之前的预估略少。按目前平均值对接收量的预估也下降到879件,比我们之前认为可能接近10...
|

|
FDA仿制药审评积压数据分析
2016.05.14
我一直在试图比较积压数字、新ANDA接收量和在企业手中的需要回应FDA完全回应函(CRL)的申请,这相当棘手。但我想我现在已经有所收获,我希望我是对的!过去用来计算GDUFA之前的“积压”的方式只是在仿制药办公室(OGD)未决的ANDA。现在的计算方式包括等待OGD审评的ANDA和在企业中待回复...
|

|
FDA 2016财年4月ANDA批准数据
2016.05.05
仿制药办公室(OGD)四月完全批准(AP)53件ANDA,发布16件暂时批准(TA)。2016财年到目前为止共批准399件ANDA,平均每个月批准57件,比2015财年平均41件的月批准量增长29%。2016财年前7个月的暂时批准总量为109件,平均每月15.5件,2015财年每月平均暂时批准量为10件。这意味着暂时批...
|