
|
FDA 更新所有非甾体抗炎药标签警告,可能波及更多药...
2024.12.04
美国 FDA 于 11 月 21 日发布了一批 400 多个含有非甾体抗炎药(non-steroidal anti-inflammatory drugs,NSAID)的药品的补充标签批准,从阿司匹林、布洛芬到双氯芬酸钾。
在药品审评与研究中心(CDER)同一天更新的药品安全性相关标签变更(Drug Safety-related Labeling Cha...
|
|
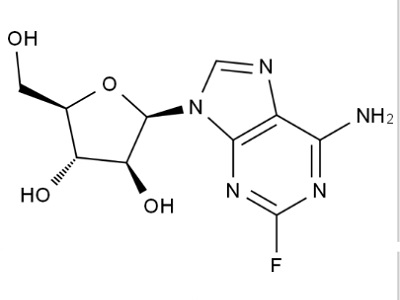
FDA 更新33年历史的老抗癌药标签,增加新剂量删除黑...
2024.11.22
美国 FDA 于 11 月 20 日宣布批准了山德士的一款数十年历史的白血病药物磷酸氟达拉滨注射液的更新标签,这是 FDA 肿瘤卓越中心(OCE)发起的一项更广泛的举措 — “项目更新(Project Renewal)”的一部分,该计划旨在更新某些较早的抗肿瘤药物的标签信息,以确保信息具有临床...
|
|
FDA 发布药物相互作用标签指南草案
2024.10.29
美国 FDA 于 10 月 21 日发布了《人用处方药和生物制品标签中的药物相互作用信息》的指南草案,描述了在标签的药物相互作用(Drug Interaction,DI)部分应包含和不应包含的内容,以及药物相互作用信息应如何出现在产品标签的其它区域。
FDA 表示,指南的目标是向申请人提供如...
|
|
标签剔除:法院在诺华诺欣妥案中支持 FDA 对标签剔...
2024.10.29
最近美国联邦哥伦比亚特区地方法院的一项新裁决支持了 FDA 对 Hatch-Waxman 修正案中“相同标签”条款的解释,为仿制药生产商保留了一条重要的途径 — 无论是省略还是修改标签,标签剔除得以幸存。
“标签剔除(label carve-out)”或称“缩减标签(skinny label)”指的是,...
|

|
FDA 将在批准前 6 到 8 周与申请人沟通上市后要...
2024.09.26
美国 FDA 于 9 月 19 日发布了修订版政策和程序手册(MAPP)6010.8 Rev. 2 “新药申请(NDA)和生物制品许可申请(BLA):向申请人传达与标签、预期上市后要求和 506B 上市后承诺有关的目标日期”,建立了关于向申请人沟通标签、预期上市后要求(PMR)和上市后承诺(PMC)意...
|

|
FDA 发布新药和仿制药标签成分声明指南草案,解决定...
2024.05.07
美国 FDA 于 4 月 29 日发布了一份题为“NDA 和 ANDA 中组成声明和相应标签成分声明的内容和格式”新指南草案,描述了 FDA 对新药申请(NDA)和简化新药申请(ANDA)中组成成分声明一致性的看法。
该指南草案提供了明确的要求 — 在申请的组成声明和标签的成分声明中列出...
|

|
【周末杂谈】FDA 对生似药宣传的监管
2024.04.28
原研药、可替换及普通生似药的法律、商务和科学名分
上期的周末杂谈提到FDA向国会提交的修法建议中,有一条是“所有批准的生物类似药(简称生似药)都自动具有可替换性”。这周三,FDA发布了修订《生物类似药宣传标签和广告活动问答指南》,告知药业在原研药、可替换生似药和普通生似药...
|

|
FDA 修订生物类似药宣传标签和广告活动问答指南
2024.04.26
美国 FDA 于 4 月 24 日发布了题为“处方生物参照药品、生物类似药和可互换生物类似药的宣传标签和广告考量问答指南”修订草案,以解决制药商、包装商、分销商等利益相关方在为根据《公共卫生服务法》(PHSA)获得许可的处方参照产品、生物类似药和可互换生物类似药编制受 FDA 监...
|

|
【周末杂谈】标签与监管 – 处方药与 OTC 药
2024.03.17
药品监管的松紧,要与药品的使用联系起来看
处方药和非处方药(OTC),哪个监管得更严?对这个问题的回答,几天前,对笔者来说是显而易见的:当然是处方药严了。新药上市后多年,经过或不经过仿制药阶段,当其安全性和有效性得到了充分确认后,经企业申请和FDA批准,才能成为OTC药。而且O...
|

|
FDA 发布非处方药 NDA 和 ANDA 的年度报告标签变...
2024.03.13
美国 FDA 于 3 月 12 日发布了一篇题为“非处方药(OTC)新药申请(NDA)和简化新药申请(ANDA)可年度报告的标签变更”指南草案,就可能在年度报告中提交的 OTC NDA 和 ANDA 产品标签变更类型提供了建议。
FDA 批准 NDA 或 ANDA 后,申请人可以对已批准的申请进行变更,...
|

|
FDA 允许酸奶企业标称酸奶可降低 2 型糖尿病风险
2024.03.04
昨日,周末杂谈栏目介绍了治疗糖尿病和减肥的前沿医疗器械。今天我们看看美国 FDA 上周五发布的一则关于酸奶降低 2 型糖尿病风险的消息。
FDA 于 3 月 1 日在一封请愿回复信 中宣布,其无意反对使用关于食用酸奶和降低 2 型糖尿病风险的某些合格健康宣称,前提是合格的...
|

|
FDA 发布定稿指南,关于在直接面向消费者广告中提供...
2023.06.29
美国 FDA 于 6 月 27 日发布了关于对人用和动物用处方药和生物制品直接面向消费者(DTC)的促销标签和广告中提供风险和有效性信息的定稿指南。
定稿指南为企业提供有关如何使用“消费者友好”语言,以及如何呈现为药品和生物制品 DTC 编制广告和促销材料的建议,其中包括有关概...
|
|
FDA 发布新的患者用药信息标签拟议规定,帮助提高用...
2023.06.01
美国 FDA 于 5 月 30 日提出了一项新的药物标签规定,旨在让患者更容易理解如何用药,同时提高处方依从性,为制药商和监管机构节约时间和资源。
新拟议规定要求制药商发布一页纸的患者用药信息(Patient Medication Information,PMI),该规定适用于处方药、某些生物制剂以及...
|

|
研究人员敦促 FDA 加强对加速批准药品标签的监管
2023.03.09
最近发表在《药物治疗》(Pharmacotherapy)上的一篇新的分析文章1表明,美国 FDA 加速批准的药物中超 10% 不符合 FDA 2019 年发布的关于加速审批药品标签的指南要求。研究人员指出,缺乏标签透明度会影响处方习惯,呼吁 FDA 通过与制药商开会、发警告信和处以罚款来确保标签合规。
...
|

|
FDA 发布联合用药方案中的交叉标签肿瘤药定稿指南
2022.11.04
美国 FDA 于 11 月 2 日发布了《联合用药方案中的交叉标签肿瘤药》定稿指南,对于被批准用于联合用药方案的肿瘤药标签中应包含的信息提供建议。
肿瘤学中的药物批准通常通过在当前治疗方案中添加药物或通过在联合用药方案中组合研究用药来建立治疗效果,从而创造出更有效的新方...
|

|
【周末杂谈】咬文嚼字:治疗等效性
2022.08.14
对药学等效、生物等效、标签条件等概念的认知
7月20日,FDA发布了“评估治疗等效的工业界指南 (Evaluation of Therapeutic Equivalence – Guidance for Industry)”的征求意见稿,给出了FDA对疗效等效性的最新认知。全文长14页纸,包括:
治疗等效性的基本概念,
FD...
|

|
【周末杂谈】咬文嚼字:Label与Labeling的异同
2022.05.01
从法规角度,看对药品标签、说明书、及介绍材料的监管
若要用一句话说 FDA 是监管啥的,那就是监管标签的。可见标签的重要性。在美国《药品法》及 FDA 规章和指南中,常出现两个词,label 和 labeling,中文都可译为标签,但意思有所不同。这不是单纯的翻译问题。美国《药品法》...
|

|
FDA 时隔 20 年更新参照药品标签修订后修改仿制药...
2022.01.27
美国 FDA 于 2022 年 1 月 26 日发布《RLD 标签修订后修订 ANDA 标签》行业指南草案。指南提供了在参照上市药品(RLD)的标签修订后更新简化新药申请(ANDA)标签的建议,包括有关如何识别 RLD 标签更新以及如何对未批准和已批准的 ANDA 提交标签更新信息以符合 RLD 标签更...
|

|
仿制药标签修订和孤儿药专营权成本回收法案美国众议院...
2020.11.20
最近美国众议院全院会议期间通过了一系列法案,其中有两件与 FDA 相关的重要立法:仿制药标签法案和孤儿药专营权法案。
依据《对新标签做出客观药物证据修订法案》(MODERN 标签法案)(H.R. 5668),即使参照产品已经撤市,使得标签处于“冻结”状态,FDA 也可以强制要求变更仿...
|

|
仿制药标签修订新篇章:新法案将以合理方式提供变更路...
2020.07.22
7 月 15 日,美国众议院能源和商业委员会投票通过了H.R. 5668
《2020 年对新标签客观药物证据修订法案》(2020 MODERN 标签法案),该立法概述了当参照上市药品不再销售时进行仿制药标签变更的方法。
关注识林的读者对于仿制药标签变更方面的重要性和问题可能已经不陌生,我...
|