
|
FDA在审351(k)申请之“专利之舞”进展
2015.10.11
+BPCIA与Hatch Waxman对照
无橙皮书和专利声明
批准后无30个月遏制期
首仿专营权仅限于“可替代的”生似药
药房不会自动替代
“专利之舞”争议解决路径更为复杂
商业上市前180天通知是强制性条款(类似于FDA批准后自动的180天临时禁令)
为证明生物类似性很可能需要临床研...
|

|
FDA对生物类似药的工作量、花费在2015年大增
2015.09.25
东方研究集团(ERG)在本周二发布了《生物类似药的审评 – 工作量和花费研究》的中期报告(Review of Biosimilar Biologic Product Applications - Study of Workload Volume and Full Costs),可以看出,最近FDA开始加大花费和增加人员了。
p1=背景
按照2012年...
|

|
美国FDA批准的Zarxio标签被Abbvie挑战
2015.09.22
9月17日,FDA药品审评与研究中心主任Janet Woodcock,在参议院听证会上,因尚未发布可替换性、标签、命名的指南被多位参议员质问。本文主要通过Abbvie向FDA递交的公民请愿,说明Abbvie公司、行业协会、参议院等对Zarxio标签的不满。
2015年3月6日,Zarxio成为首个美国FDA许可的生物类...
|

|
生似药的监管科学基础尚在发展中 - FDA在参议院的...
2015.09.19
9月17日,FDA药品审评与研究中心主任Janet Woodcock,出席参议院健康、教育、劳工与养老金委员会(HELP)听证会,报告生物类似药方面的进展。她在听证会上强调,开辟稳健的美国生物类似药市场并建立法规支持体系,最重要的部分之一是确保科学框架“刀枪不入”。在听证会上,她谈到了一系...
|

|
山德士宣布:Zarxio在美国上市
2015.09.07
2015年9月3日,诺华的子公司山德士宣布:ZarxioTM(filgrastim-sndz)重组人粒细胞集落刺激因子,在美国上市。Zarxio是美国FDA批准的第一个,也是第一个在美国上市的biosimilar。Zarxio在2015年3月获得FDA批准,其后因为Amgen的诉讼,巡回法院支持其临时禁止令的请求,直至7月“三人法庭...
|

|
FDA生物制品命名,额外指定随机后缀?
2015.08.28
今年早些时候,FDA批准了首例生物类似药,还有一些生似药产品在研。但一个关键问题是,如何给生物药命名以保证安全使用并促进新产品的接受。8月27日,FDA发布了业界期待已久的生物类似药命名指南(行业指南 – 生物制品非专利名命名)。FDA拟议给所有生物制品,包括参照产品和生物类似药...
|

|
联邦巡回法院法官关于“专利之舞”条款意见不统一,诉...
2015.07.26
2015年7月21日,一个观点分裂的联邦巡回法院3人法庭发布了关于Amgen公司与Sandoz公司之间在(“BPCIA,生物制品价格竞争与创新法案”)法案下各种法律问题争议的决定 (也被称为“aBLA”,或简略生物制品许可申请)申请人可以遵守也可以不遵守;同时支持Amgen公司有关生物类似药申请人只...
|

|
原研和仿制角力生似药专利攻防(一)-宣言判决
2015.05.18
编者按:首个生物类似药已获批准,但是相关法律诉讼远未结束。仅就信息交换程序而言,作为原研一方,安进在二月提出禁制令(Preliminary injunction),相关诉讼还在等待六月份巡回法院的裁定;而另一方面,回顾不同生似药厂商所作过的宣言判决(Declaratory judgment),也有助于...
|

|
下个月3日,“专利之舞”音乐声起,应该期待什么?
2015.05.17
说起美国的生物类似物和生物制品价格竞争与创新(BPCI)法案建立的PHS法案351(k)路径,会不可避免地提到Sandoz和Amgen之间的两个案例,从首个351(k)专利诉讼(Enbrel)止步联邦巡回法院,到FDA批准的首个351(k)生物类似物(Zarxio)因未决诉讼迟迟无法上市,或许我们应该期待在6月...
|
|
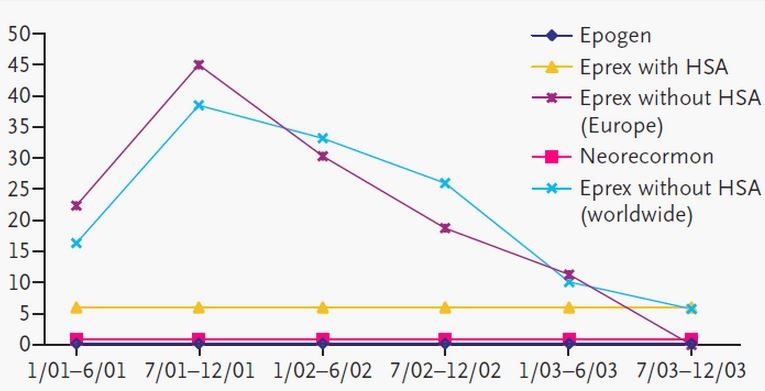
【旧闻】一例重组生物制品处方变更引发的风波
2015.04.07
1998年,由抗EPO抗体诱发的纯红细胞再生障碍性贫血(PRCA)发生率突然升高,且大多发生在皮下注射Eprex(EPO alfa)的慢性肾损伤患者身上...In 1998, an increase in the incidence of pure red cell aplasia (PRCA) was observed that was associated with anti-erythropoieti...
|

|
美国首个生物类似物上市道路曲折
2015.03.11
3月6日Zarxio (filgrastim-sndz, 山德士公司Neupogen 非格司亭的仿制版本) 获得了FDA首个生物类似物批准后,山德士要做的事情,是将Zarxio真正摆上货架,写在处方当中,但目前山德士将面临的法律和商业上的障碍,并不会比他们刚刚解决的监管上的阻碍来得更加轻松。
虽然得到了FD...
|

|
FDA批准首个生物类似物
2015.03.06
2015年3月6日FDA批准首个生物类似物在美国使用,为将一整类复杂且昂贵的药品的替代产品推向市场铺平了道路。
该药品是由Sandoz公司生产的Zarxio,用于帮助人体在癌症治疗中制造白细胞,是现有药品Neupogen的极相近的仿制品。Zarxio于2009年在欧洲以Zarzio的名字获批,但一直没有在美国...
|

|
重磅药品的生物类似物在欧洲主要市场推出
2015.02.25
治疗类风湿关节炎和克罗恩病畅销药品的生物类似物正在欧洲各地主要市场推出,标志着生物类似物的又一重要进展。由韩国公司Celltrion及其合作伙伴Hospira和Mundipharma公司生产的生物类似产品,将与强生和默克公司的原研品牌药英夫利昔单抗(Remicade)竞争市场。
未上市公司Mundipharma...
|

|
对美国首例生物类似物专家会审的看法
2015.01.13
作为Amgen公司肿瘤生物药Neupogen®的生物类似物,Novartis公司的Zarxio获得美国专家的推荐,该药有望成为美国第一个上市的生物类似物。FDA专家建议批准Zarxio用于治疗原研药Neupogen®批准治疗的所有5个适应症。治疗的目的是提高癌症患者的白细胞数量。FDA本身将会于3月份决定是否批准该...
|

|
2014 FDA-CMS峰会:新医改下的医药创新
2014.12.17
作者:识林-檺
2014年12月11-12日,第十届美国食品药品管理局(FDA,Food and Drug Administration)和美国卫生部医疗保险和医疗救助中心(CMS,Centers for Medicare and Medicaid Services)年度联合峰会在华盛顿召开。峰会讨论了新医改形势下,药品研制、监管、定价、报销...
|

|
我国生物类似物技术指南姗姗来迟
2014.10.29
更新附注,该征求意见稿已于2015年3月发布新的试行版本,详见 生物类似药研发与评价技术指导原则 (2015-03)
多种生物制品专利期临近,各国为缓解医保压力、提高药品可及性,均着手完善生物类似药(Biosimilar) 的监管要求。我国生物类似物研发与评价技术指导原则(征求意见稿...
|

|
紫皮书,还不能与橙皮书相提并论
2014.09.15
紫皮书,还不能与橙皮书相提并论
— FDA的生物药列表空缺两个时间项,没有相关专利信息
FDA在9月9日,公布了CDER、CBER两个中心已许可的生物药列表(CDER BLA ),分别列了104个、276个BLA产品的信息。该紫皮书列表的更新请关注FDA网站。表格第一行有8项:BLA申请号(BLA STN)、通用名...
|

|
雅培生命、安进与罗氏面临生物类似药市场挑战
2014.02.27
雅培生命、安进与罗氏面临生物仿制药市场的挑战
全球信用评级-2014年2月25日
穆迪投资者服务公司在新推出的报告《生物类似药:分析企业产品线》中提到,众多公司正竞相拓展全球生物类似药药市场。监管生物仿制药已在亚洲与欧洲上市,但距离在全球最大的药品市场美国面市还需要至...
|

|
首个单抗生仿药欧盟获批
2013.09.10
2013年6月,欧洲药品管理局(EMA)CHMP推荐批准生物类似物Inflectra(infliximab,英利昔单抗)原文
2013年9月10日,EC批准上市销售原文
Inflectra是强生(JNJ)和默沙东(Merck & Co)重磅药物Remicade(类克,infliximab)的生物类似药,同时也是通过欧洲药品管理局(EMA)生物仿制...
|