
|
FDA 推出增强版在线紫皮书数据库
2020.02.27
美国 FDA 于 2 月 24 日宣布其推出了第一版可搜索的生物产品信息在线数据库,即在线“紫皮书”。紫皮书于 2014 年首次发布,之前为 PDF 列表形式,现在可以更轻松地对紫皮书进行在线搜索,并包含了有关产品名称(通用名和专利名),所提交的生物制品许可类型,生物制品的规格、...
|

|
FDA 提出生物类似药增加适应症的简化路径
2020.02.08
美国 FDA 于 2 月 6 日发布一篇题为《生物类似药和可互换生物类似药:少于参照药品已获许可的所有使用条件的许可》的新指南草案,旨在为生物类似药申办人提供一种高效的途径,使其能够在标签上添加新的或先前受保护的参照产品适应症。
FDA 表示,生物类似药和可互换生物类似药申...
|

|
FDA 和联邦贸易委员会联手促进生物药市场竞争
2020.02.05
美国 FDA 与联邦贸易委员会(FTC)于 2 月 3 日发表联合声明,承诺加强合作,推动生物制品市场竞争,制止反竞争行为。
联合声明表示,FDA 和 FTC 将合作促进生物制品和生物类似药市场的更多竞争;阻止阻碍获取开发这些产品所需样品的行为;对有关这些产品的虚假或误导性沟通采...
|

|
FDA 严禁在宣传标签中暗示生物类似药不如参照产品
2020.02.05
美国 FDA 于 2 月 3 日发布了一份题为《处方生物参照药品和生物类似药的宣传标签和广告考量》的问答指南草案,明确警告在宣传推销活动中不要表示生物类似药比其参照产品劣效或不同。
该指南草案共八个问题解答,这些问题旨在帮助企业在广告或宣传材料中描述产品之间的相似性和差...
|

|
WHO 预认证首个生物类似药曲妥珠单抗
2019.12.20
世界卫生组织(WHO)于 12 月 18 日预认证了首个生物类似药 — 曲妥珠单抗,此举可能使这一昂贵的、挽救生命的治疗药物更加经济实惠,可供全球女性使用。
曲妥珠单抗于 2015 年被列入 WHO 基本药物清单,是 20% 的乳腺癌的基本治疗方法,已显示出在治愈早期乳腺癌以及在某...
|

|
FDA 关于低价生物类似药和可互换蛋白质产品的声明
2019.12.17
Statement on low-cost biosimilar and interchangeable protein products
For Immediate Release
Statement From
December 17, 2019
Deputy Commissioner for Policy, Legislation, and International Affairs - Food and Drug Administration
Anna Abram
Direct...
|

|
FDA 努力帮助提高生物类似和可互换胰岛素产品的开发...
2019.11.25
Statement on efforts to help make development of biosimilar and interchangeable insulin products more efficient
For Immediate Release November 25, 2019
Statement From Acting Commissioner of Food and Drugs - Food and Drug Administration, ADM Brett P...
|

|
生物类似药可互换性的价值饱受质疑
2019.11.11
最近普享药协会(AAM)举办的 GRx+Biosims 2019 会议上讨论了许多热点问题,今天我们来看看有关生物类似药方面的话题。行业代表在会上表示,鉴于美国市场的商业动态,在支持可互换性认定的转换研究上投入时间和资源对生物类似药申办人来说可能并不值得。
来自 Sandoz、Mylan 和三星 B...
|
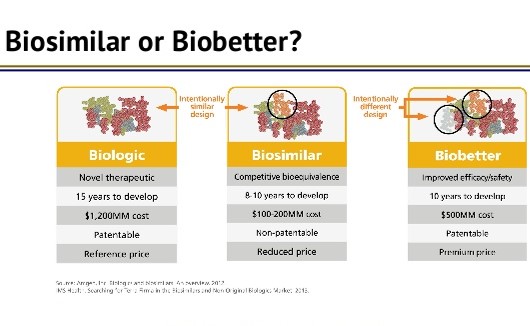
|
FDA 药品中心主任关注 biobetter,乐观看待生物类似...
2019.10.05
美国 FDA 药品审评与研究中心(CDER)主任 Janet Woodcock 于 9 月 23 日在药物信息协会(DIA)生物类似药会议上发表演讲,对美国生物类似药市场的未来表达了总体乐观的态度,但同时也惋惜地指出《生物制品价格竞争和创新法案》(BPCIA)缺乏“biobetter”路径。
Woodcock 表示,...
|

|
FDA生似药比对分析评价指南行业反馈摘选
2019.08.14
生物类似药申办人对于美国 FDA 放弃对一些比对分析评价要求统计等效性检验要求的决定普遍表示支持,但对于定量数据分析、参照标准品确认和国外参比品的使用持怀疑态度。
FDA 于今年五月份发布《治疗性蛋白质生物类似药的开发:比对分析评价和其它质量考量》指南草案(中文翻译),修...
|

|
美国行业协会关于专利滥用阻止生物类似药竞争的分析
2019.07.29
美国普享药协会(AAM,原仿制药协会)生物类似药委员会于 6 月 25 日发布了一份关于专利滥用阻止生物类似药上市销售的白皮书,分析了获得 FDA 批准而未能上市的 8 个生物类似药,得出由于专利滥用导致生物类似药延迟上市而给医疗保健系统带来的损失达 76 亿美元。同时提出了促...
|

|
美国生物药是否真的需要 12 年市场专营权?
2019.06.24
人们普遍认为生物药由于其复杂性,开发过程耗时且昂贵。因此《生物制品价格竞争与创新法案》规定生物药的专营权期限为 12 年。相比之下,Hatch-Waxman 法案规定新分子实体专营权为五年。但 6 月 18 日发表在《自然 – 生物技术》(Nature Biotechnology)上的一项研究通过分析...
|

|
FDA 发布生物类似药比对分析及其它质量考虑指南草案
2019.05.23
美国 FDA 于 5 月 21 日发布《治疗性蛋白质生物类似药的开发:比对分析评价和其它质量考量》指南草案。指南介绍了 FDA 对于支持生物类似性证明的比对分析研究的设计和评价的建议,包括开发使用逐步方法的比对分析评价计划的考量。指南还向申办人提供了有关拟议生物类似药产品上市...
|

|
FDA 生物可互换性定稿指南重点变化解读
2019.05.14
美国 FDA 于 5 月 10 日公布了备受期待的《证明与参照产品可互换性的考量》定稿指南。识林之前发布了一篇概要性资讯【FDA 生物类似药可互换性指南定稿 2019/05/11】。随后识林对定稿指南与 2017 年 1 月的指南草案做了花脸稿详细对比,并总结了一些有用且重大的变化列举如下...
|

|
FDA 生物类似药可互换性指南定稿
2019.05.11
自 2015 年首个生物类似药获得美国 FDA 的批准以来,生物类似药的使用及其在市场上的应用方面的问题一直是讨论焦点。FDA 于 5 月 10 日发布了一份业界期待已久的定稿指南 —《证明与参照产品可互换性的考量》,指导企业如何证明生物类似药与其参照许可产品的可互换性。
该指南定稿...
|

|
FDA 药品中心主任回应生物药命名质疑,批评企业并不...
2019.03.28
自美国 FDA 发布最新的生物药非专利名命名指南,决定不再给最初获批时没有随机四个字母后缀的创新生物药补加后缀以来,生物类似药企业就感到十分不满。但 FDA 药品审评与研究中心(CDER)主任 Janet Woodcock 表示,这些反对意见可能代表了行业利益相关者与面临现实问题的处方者和...
|

|
FDA 新生物制品命名政策,不再要求原有生物药添加后...
2019.03.09
美国 FDA 于 3 月 7 日发布更新版的《生物制品非专利名》指南草案,将不再要求已批准的原始生物制品专有名(proper name)包含四个字母的后缀,但对于未来的批准,FDA 将继续添加后缀。这一新办法可能对生物药行业产生广泛影响。
FDA 在更新的指南中表示:
将继续对新批准的...
|

|
公众对生似药与复杂仿制药的接受程度不尽如人意?
2018.08.16
许多文章都曾谴责这样一个事实,即,对生物类似药的使用程度远低于美国 FDA 或业界预期。我已经在这个行业以不同身份工作了 46 年(药剂师、监管者和顾问),见惯了这样的情况。有人说历史再次重演,但今天的观念和力量与 Hatch-Waxman 法案首次颁布时的是一样的。什么观念和力量?...
|

|
WHO 生物类似药问答指南草案中文翻译
2018.08.12
两周前,WHO 发布《生物类似药问答指南草案》,识林对指南内容做了简要介绍【WHO 就八年来生物类似药的常见问题给出指导 2018/07/31 】。识林现已将指南草案译成中文。
问答草案涉及概念、参照生物药、质量、非临床、临床和药物警戒六大块共 48 个问题。其中包括对于在什么情况...
|

|
WHO 发布生物类似药问答指南草案
2018.07.31
世界卫生组织(WHO)于 7 月 26 日发布生物类似药问答指南草案,邀请利益攸关方提出反馈意见。该指南草案一经定稿将有助于进一步支持 2009 年生物类似药评估指南的实施。问答草案基于监管机构在过去八年中关于如何落实 2009 年指南的常见问题。WHO 将在 9 月 20 日之前接收有...
|