
|
FDA 发布两指南为新冠治疗药研发和临床研究提供具体...
2020.05.14
美国 FDA 5 月 11 日发布了两篇指南,旨在加速开发用于治疗或预防新型冠状病毒疾病(COVID-19)产品的开发,指南为帮助企业顺利进入研究用新药申请(IND)阶段提供了建议,并提供了有关后期研究临床试验设计的考虑。
这两篇新指南在 FDA 于 三月份启动 FDA 冠状病毒治疗加速计划...
|

|
欧盟关注临床试验使用的计算机化系统验证
2020.04.17
欧洲药品管理局(EMA)最近发布通告,表达了对最近检查揭示的临床研究中使用的计算机化系统缺乏验证和确认的关注。
EMA 在通告中表示,未能记录和证明计算机系统的已验证状态可能会对数据完整性、可靠性和稳健性造成威胁。取决于受影响数据的严重程度,可能会导致 GCP 检查员建议不...
|

|
REMAP-CAP:应对大流行的全球临床试验
2020.04.11
前两天我们介绍了横跨整个英国的最大新冠临床试验 RECOVERY 【英国启动最大新冠临床试验,两周入组近千人】,文中提到 RECOVERY 是英国同时开展的三项“国家优先临床试验之一”,今天我们来看看这三个优先临床试验的另外一个:REMAP-CAP。
对于新型冠状病毒疾病(COVID-19)患者...
|

|
英国启动最大新冠临床试验,两周入组近千人
2020.04.09
一项横跨整个英国的针对新型冠状病毒疾病(COVID-19)治疗药的随机临床研究可以帮助巩固英国作为未来临床试验场地的声誉。这项研究被视为英国监管机构对潜在 COVID-19 治疗药物的“果断行动”的一部分,试验已创下许多记录,任何 18 岁以上因 COVID-19 住院的患者均获邀参加。
该...
|

|
FDA 放宽有关罕见病基因治疗药物安慰剂对照试验的限...
2020.04.08
今年1月底,FDA公布了《罕见病基因治疗》(Human Gene Therapy for Rare Diseases)的定稿指南。在指南中,FDA拒绝了利益相关者关于取消安慰剂对照试验的要求,但是通过增加 “当可行时”的前置描述,使这一建议在实际操作中的灵活性有所提高。同时,考虑到业界对2018年指南草案中关...
|

|
药企应警惕实验室因临床时间压力而放行不可靠数据
2020.04.06
当前,为应对全球新型冠状病毒疫情(COVID-19)大流行,很多制药公司和研发机构都在紧锣密鼓的开展旨在证明药物对 COVID-19 有效性的临床试验,但此时对临床过程中的实验室数据更不能掉以轻心,数据的可靠性将直接影响临床试验进展和决策,进而影响患者治疗和疫情控制。英国监管机构 M...
|

|
FDA 药品中心主任谈疫情下审批和检查工作,新冠治疗...
2020.04.02
美国 FDA 药品审评与研究中心主任 Janet Woodcock 医学博士最近在家远程接受采访,讨论了在新型冠状病毒疫情(COVID-19)影响下的审评截止日期、批准前检查以及社交疏离时代如何召开咨询委员会会议等问题。
Woodcock 表示,尽管包括抗病毒、重症监护和肺部疾病在内的应对应对疫...
|

|
欧盟发布新冠疫情期间临床试验管理指南,美国放松不良...
2020.03.23
欧盟委员会、欧洲药品管理局(EMA)和药品局总部(HMA)于 3 月 20 日发布了关于制药公司如何在新型冠状病毒疾病(COVID-19)大流行期间管理临床试验的指南。
与 FDA 于 3 月 18 日发布的指南相似【FDA 对于疫情期间临床试验的执行提供建议 2020/03/19】,EMA 这份 8...
|

|
远程分散式临床试验的考量要点
2020.03.20
昨日我们介绍了 FDA 发布的关于在新冠疫情(COVID-19)期间开展临床试验的最新指南【FDA 对于疫情期间临床试验的执行提供建议】,今天我们来看看更具灵活性的远程分散式临床试验在这一特殊时期以及今后能够申办人带来怎样的可能性,以及如果开展此类试验需要注意些什么。
随着人们...
|

|
FDA 对于疫情期间临床试验的执行提供建议
2020.03.19
美国 FDA 于 3 月 18 日新发布了《关于新型冠状病毒疾病(COVID-19)大流行期间医药产品临床试验的执行》定稿指南,帮助申办人确保试验参与者的安全,保持临床试验质量管理规范(GCP)的合规性并最大限度地降低 COVID-19 大流行期间试验完整性(integrity)风险。
美国国家卫...
|

|
英国 MHRA 关注新冠疫情引发的临床试验相关偏差上升
2020.03.14
英国药品与医疗保健产品监管机构(MHRA)表示,由于新型冠状病毒肺炎(COVID-19)疫情爆发,预计正在开展的临床试验中与试验方案相关的偏差将会增加。世界卫生组织(WHO)于 3 月 11 日宣布 COVID-19 疫情为全球大流行(pandemic)。【WHO 宣布全球大流行,FDA 暂停境外检查和外部会议...
|

|
FDA 新发布指南鼓励将老年患者纳入癌症临床试验
2020.03.11
美国 FDA 于 3 月 5 日发布指南草案《在癌症临床试验中纳入老年患者》,希望鼓励制药商在癌症临床试验中纳入更多老年患者,以确保这些研究中的患者人群能够更好地反映真实世界中的患者人群。
FDA 肿瘤卓越中心主任 Richard Pazdur 表示,“在临床试验中招募广泛的患者代表是...
|

|
80 多项新型冠状病毒肺炎治疗药物临床试验正在开展
2020.02.18
根据中国临床试验注册中心数据显示,针对新型冠状病毒肺炎(COVID-19)新药和传统中药试验注册登记数量与日俱增,由于没有已知的治疗方法,医生渴望为感染患者提供帮助,但专家警告指出,只有仔细开展临床试验才能确定哪种治疗方法是有效的。
世界卫生组织首席科学家 Soumya Swaminath...
|

|
冠状病毒临床试验设计
2020.02.04
当前在研的抗2019-nCoV病毒感染的药物有很多,已有多家机构开展临床研究。新药的临床开发经常要花费几年甚至几十年的时间(抗菌/抗病毒类药物相对研究周期较短)。面对严峻的疫情,在短期内证明一个药物对抗病毒有效还是无效,对于控制疫情很重要。
2019-nCoV的药物临床研究的挑战主...
|

|
FDA 就证明药品有效性所需的实质性证据提供更多灵活...
2019.12.23
美国 FDA 于 12 月 19 日发布《证明人用药和生物制品有效性的实质性证据》指南草案,旨在为计划提交新药申请(NDA)、生物制品许可申请(BLA)或补充适应症申请的申请人提供证明有效性所需实质性证据(substantial evidence)方面的指导。
背景
该指南补充并扩展了 1998 年...
|

|
FDA 发布药品和生物制品临床适应性设计定稿指南
2019.12.02
美国 FDA 于 11 月 29 日发布《药品和生物制品临床试验适应性设计》定稿指南。指南为恰当地使用可能随着收集数据而发展的临床试验设计提供了建议。依据新的定稿指南,制药商能够在中期对临床试验进行适应性调整,以更好地开展药物研发及临床试验活动。
适应性设计临床试验允许根...
|
|
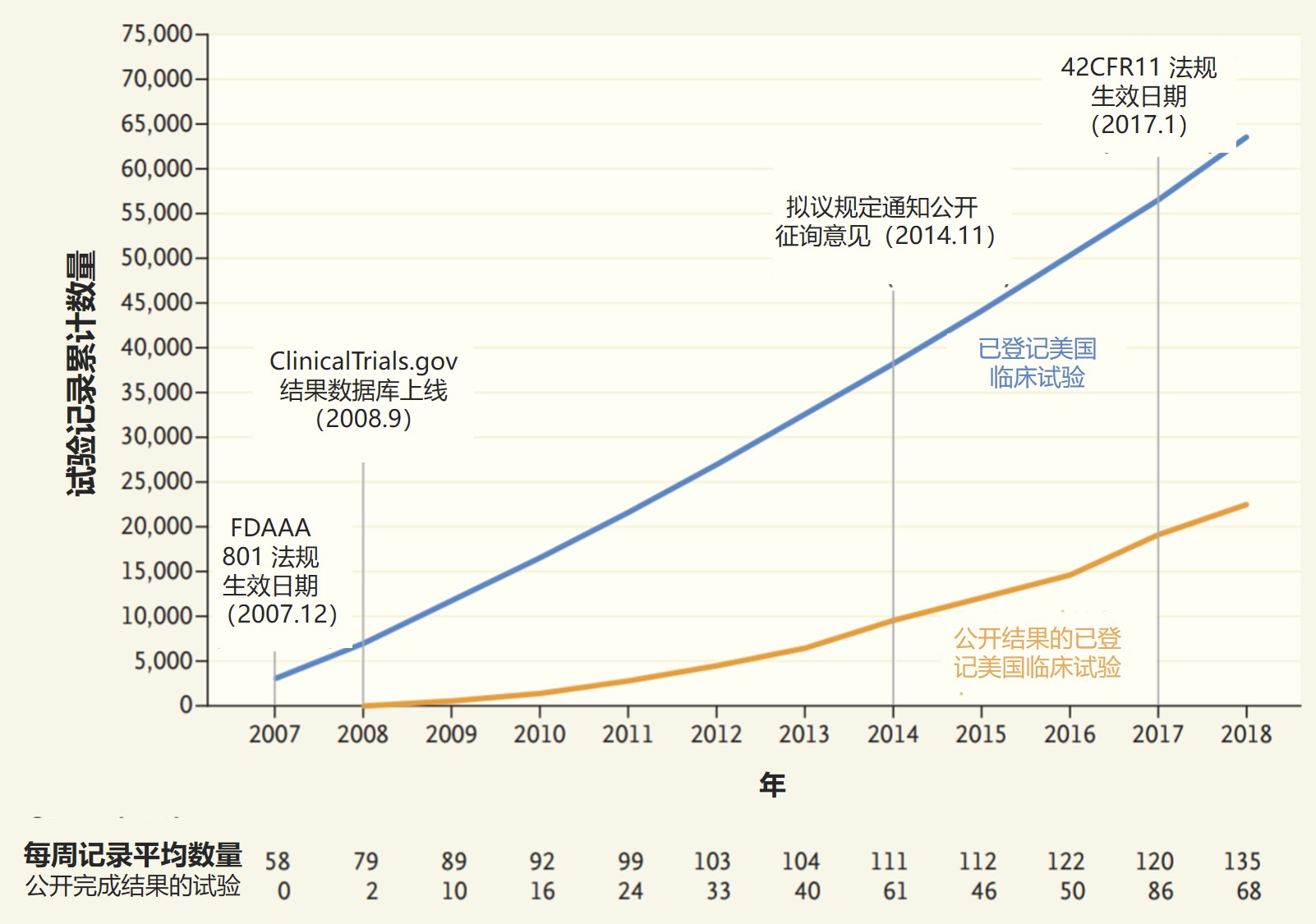
更多临床试验结果得到公开,但数据质量欠佳
2019.11.19
最新一项研究审查了在 ClinicalTrials.gov上报告研究结果的第一个十年的数据,研究显示制药公司和学术研究中心在报告人体研究结果方面取得了缓慢进展,但是数据质量可能仍存在更大的问题。这一研究于 11 月 14 日发表在《新英格兰医学杂志上》。
研究指出,数据库通过 2008 年...
|
|
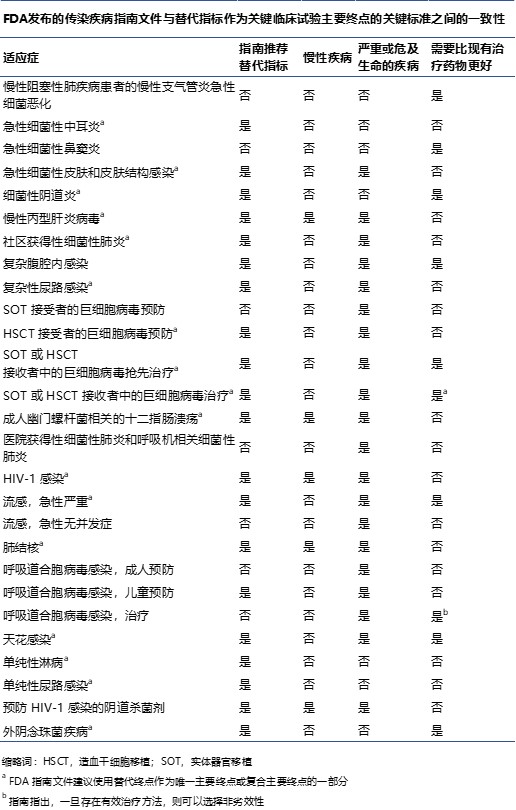
研究人员呼吁 FDA 重新考虑允许使用替代终点的指南
2019.11.16
哈佛大学和乔治华盛顿大学医学院的研究人员于 11 月 12 日在《美国医学会杂志内科学》上发表的一篇评论中指出,美国 FDA 需要在有关开发传染病治疗方法的一些指南文件中重新考虑替代结果的使用。
该评论文章评估了 22 份 FDA 发布的指南文件,包括针对 27 中疾病适应症的关...
|

|
英国议会与患者组织呼吁严惩不披露临床试验数据者
2019.08.28
英国下议院科学技术委员会主席 Norman Lamb 再次呼吁英国卫生研究局(HRA)惩治不遵守临床试验报告要求的申办者和研究者。
上周,12 个患者权益倡导组织联名向 Lamb 发信,呼吁 Lamb 向 HRA 写一封公开信,提醒 HRA 有关议会对于不遵守临床试验报告要求的惩治期望,并鼓励 H...
|

|
FDA 局长再次批评药企和 CRO 阻碍临床试验创新
2019.03.20
即将卸任的美国 FDA 局长 Scott Gottlieb 批评申办人和临床研究机构(CRO)“持续不愿意”采取创新方法开展临床试验。Gottlieb 要求工业界和学术界投资新方法并采取激励措施,使临床研究更加灵活有效。
Gottlieb 认为 FDA 的努力有助于申办人减少生成安全性和有效性数据所需的...
|