
|
开放标签试验,FDA仍鼓励患者报告结局
2022.08.12
FDA第3份以患者为中心的药物开发(PFDD)指南,旨在更好地标准化临床报告结局(Clinical Outcome Assessments,COA),患者报告结局(Patient-Reported Outcome,PRO)作为COA类型之一,指南中也建议申请人使用适合目的的工具对注册研究中的核心PRO进行系统评估。
我国CDE也于日...
|

|
西格列汀也有亚硝胺!然而,FDA这次更怕短缺
2022.08.11
FDA最近发现西格列汀(2型糖尿病药物)的某些样品中含有亚硝胺杂质Nitroso-STG-19(NTTP)。为避免药品短缺并帮助确保患者获得足够的药品供应,FDA不会反对临时分销含有超过NTTP可接受摄入量(每天37ng,最高可达246.7ng)的西格列汀。
闻“亚硝胺”色变,但并非一视同仁?
...
|
|
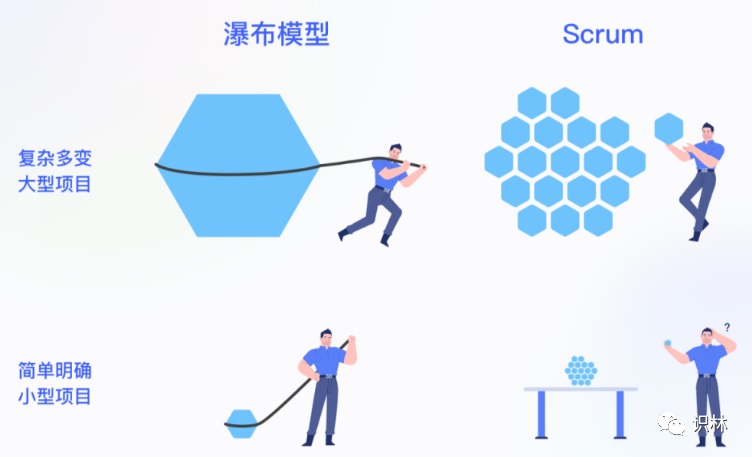
Fast Science:“快”科学和“敏捷”药物开发?
2022.08.11
长期以来,药物开发一直以缓慢的速度进行,所谓“十余年”和“数十亿美元”似乎已经形成了思维定式。许多人会担心,加快开发速度将意味着抄近路,牺牲数据的准确性,进而最终危害患者安全。如今,生物制药行业似乎站在了一个令人激动的十字路口,面临一个抉择,即是否拥抱所谓Fast Scienc...
|

|
国际药监合力,推动RWD与RWE纳入监管决策
2022.08.10
2022年7月22日EMA批准了一份由国际药品监管机构联盟(ICMRA)发布的联合声明,呼吁进行国际合作,以便生成和使用可用于监管决策的现实世界证据(RWE),另一方面也加强全球各监管机构的合作,提高应对健康威胁的能力。
真实世界数据(Real-world data,RWD)和真实世界证据(Real-world ...
|

|
专利多又不犯法!药王修美乐再赢反垄断指控
2022.08.10
修美乐(Humira)是第一个上市的全人源单克隆抗体,通过灭活肿瘤坏死因子(TNF-α)发挥作用。良好的药效、较少的副作用和便捷的给药途径使得Humira成为艾伯维(AbbVie)手中最赚钱的药物。Nature报道称,Humira在2019年和2020年的全球药品销售额分别为197亿美元和204亿美元,位居全球第一...
|

|
线上讲座:生物制品无菌工艺模拟试验的讨论
2022.08.09
为生物制药生产,在合理的利用微生物,同时控制有害微生物的生长。工艺过程中的特殊性,使其微生物管理要求相对较高,一旦细菌和真菌污染了生物制药的原材料、细胞库、细胞培养和纯化工艺以及最终阶段产品。因此其无菌生产操作尤为重要。培养基模拟灌装试验是无菌药品生产管理的重要组成内...
|

|
国际药政每周概要:BE电子提交ICSR,更新48篇BE,EDQM...
2022.08.09
【注册、审评、审批】
8.02,【FDA】指南草案 从IND豁免BA/BE研究中以电子方式提交快速安全报告
【GMP与检查】
8.04,【FDA】SOPP 8103在机构检查期间总部与受监管的生产商的联系
【CMC与仿制药】
7.27,【EDQM】通则第2.2.46.章色谱分离技术现发表于欧洲药典第11版
...
|

|
IPEM 课程 工艺验证,变更管理,质量量化统计
2022.08.08
老师简介
李晓明博士,PQS+公司创始人,曾就职于美国默克制药、美国礼来制药和浙江海正药业。在近30年制药生涯中,创立了一套完整的固体口服制剂理论和制剂药物研发、生产、工艺优化的技术和方法,在领导力培养、质量组织框架搭建、质量管理体系高效率系统化设计、跨北美...
|

|
国内药政每周导读:新冠药评价问答发出后撤回,创新药...
2022.08.08
【创新研发与临床】
8.1,【已撤回】CDE发布《关于新型冠状病毒新流行株感染抗病毒新药非临床和临床评价标准的问与答》
8.1,CDE征求《原发性胆汁性胆管炎治疗药物临床试验技术指导原则(公开征求意见稿)》意见
【CMC与仿制药】
8.1,药典会征求《中国药典药用辅料标准与IC...
|

|
处方药和非处方药之间的药
2022.08.07
FDA拟新设一档药类:带附加条件的非处方药OTC - ACNU
非处方药的英文是OTC drug(over the counter drug),其中counter指柜台。Over the counter就是柜台外边的意思。若是直译的话,OTC药可称为“柜台外的药”。例如,美国药店里处方药是放在柜台里边的货架上,标识Rx,凭医...
|

|
识林小程序发布啦!学习与分享,随时、随地、随心!
2022.08.06
识林是药业法规“维基百科”和知识学习平台,大家已经可以在手机APP上迅速查阅法规指南,也可以在PC上深度学习,那么识林小程序,又可以为您做些什么呢?
*您可扫描下方二维码,绑定/注册识林小程序*
或者,带着您的问题,也带着识林小程序的功能关键词,一起在简洁明快的视...
|

|
FDA指导一次性生产材料变更,避免无菌药品短缺
2022.08.05
在COVID-19公共卫生紧急情况期间,由于需求增加,FDA关注到一次性生产材料供应量受限的问题,可能会影响无菌药品和生物制品的供应链安全。
7月29日,FDA发布问答指南,为制造商提供了关于一次性生产材料批准后变更报告的明确信息。该指南由药品审评和研究中心(CDER)的药品质量办公室...
|

|
药也上天了,认识太空站里做药物研究的先行者
2022.08.05
Redwire公司称自己为下一代太空经济的空间站建设领导者。近日其宣布,将开发新的太空制造技术,用以研究生产蛋白质基药物和其他重要药品相关分子的小批量晶体。他们的太空制药实验室——生物晶体优化实验(PIL-BOX)将为商业客户和研究人员提供微重力创新平台,改善药物的发现和开发过程...
|

|
美版“医保国谈”法案几乎板上钉钉,业界一片哗然
2022.08.04
在临近参议院“暑假”休会的关头,民主党终于等来了好消息。参议院多数党领袖Schumer与参议员Manchin达成了协议,准备全速推动名为the Inflation Reduction Act of 2022的法案进入后续程序,该法案是经过大半年胶着的Build Back Better Act经过几轮谈判缩水后的成果,其中包括了气候、M...
|

|
罕见病困局到底如何破?监管与业界博弈中合作
2022.08.04
“罕见病”一词既贴切又用词不当。就个体而言,每种罕见疾病影响的人数相对较少。但总的来说,美国有超过3000万人、全世界有4亿人患有罕见病,其中95%的罕见病无药可治,50%以上的罕见病患者是儿童,而其中三分之一活不到5岁。
尽管罕见病患者迫切需要创新疗法,但像为Covid-1...
|

|
“发补”该交了!FDA指南要求ANDA申请人及时回复完全...
2022.08.03
FDA在7月22日发布的行业指南草案终稿“在监管期限内未能回复ANDA完全回应函指南”中,期望申请人遵循监管要求,及时回复完全回应函(CRL)。
识林用户可登录阅读原文和完整翻译版本。
CRL是FDA与申请人的书面通信,内容通常是在NDA或ANDA评审中发现的缺陷(可类比为国内注册非常...
|

|
合成细胞疗法已在路上,FDA需做好监管准备
2022.08.03
发展新的医疗手段需要推动或者打破目前的治疗定义边界,其中一个边界就是对细胞的定义。目前为止,细胞都是一种纯天然的存在(beings),我们用活细胞来繁殖活细胞。但随着合成生物学家及工程师正在不断学习和创造合成细胞(非活细胞),有朝一日合成细胞可能会改变一系列疾病的治疗方式。...
|

|
国际药政每周概要:FDA癌症临床入组标准,一次性制造...
2022.08.02
【创新研发与临床】
7.26,【FDA】指南定稿 药物和生物制品的新生儿研究的一般性临床药理学考量
7.27,【FDA】指南定稿 癌症临床试验的资格标准:在无法治愈背景下的可用疗法
【注册、审评、审批】
7.27,【FDA】修订国家药品代码格式和药品标签条形码要求(初步监管影响分析...
|

|
为挽救孩子,父母自己筹建公司开发罕见病药物
2022.08.02
近乎一半的罕见病患者都是儿童1,患有罕见病的他们只有30%能活到5岁生日。一旦孩子被确诊,父母通常会辞掉工作,重新安排生活来照顾孩子,不停地寻求可能存在的治疗方法,但治愈的机会十分渺茫。
尽管据美国国立卫生研究院(National Institutes of Health)统计,罕见疾病多达7000...
|

|
国内药政每周导读:CDE盲法与M12药物相互作用,医保异...
2022.08.01
【创新研发与临床】
7.25,CDE发布《药物临床试验盲法指导原则(征求意见稿)》
7.29,CDE征求ICH指导原则《M12:药物相互作用》意见
【CMC与仿制药】
7.22,CDE征求《化学仿制药参比制剂目录(第六十一批)》(征求意见稿)
【市场与上市后监管】
7.26,医保局、...
|