
|
【周末杂谈】NDMA 事件与第三方检测
2022.12.11
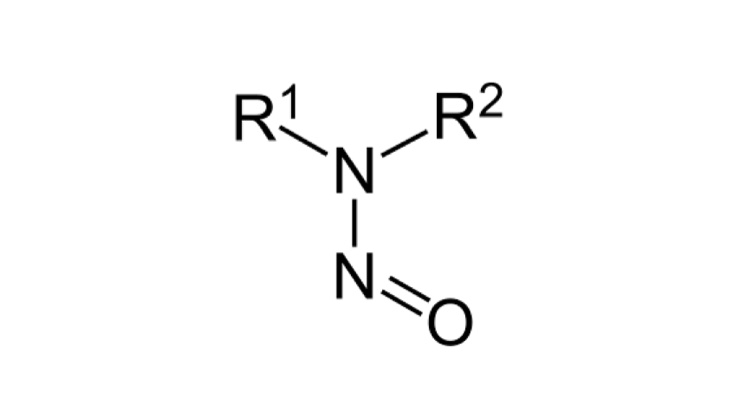
NDMA事件与第三方检测 按FDA的要求做,由FDA给你背书,应是站稳市场的最佳途径
这周二,美国FDA对最早发现雷尼替丁含致癌性物N-亚硝基二甲胺(NDMA)的实验室Valisure发出了相当于警告信的无标题信(Untitled Letter)。同日,美国联邦法院驳回了消费者对雷尼替丁生产企业因其药品含ND...
|

|
【识林新翻译】欧洲GMP基本要求,FDCA检查章节,WHO生...
2022.12.10
中外法规指南浩如烟海,为帮助用户跨越语言关,加深理解,识林将努力为识林企业用户提供法规指南翻译,并尽我们所能确保质量。
专业水平所限,差错难免,也希望企业用户在阅读学习的同时,在页面评论区提问、纠偏,企业用户还可联系我们提出法规翻译需求。
此外,识林还推出“双...
|

|
【识林新课程】FDA更新QMM与KASA进展,复杂仿制药,EM...
2022.12.10
识林升级版用户,可在PC端和App、小程序移动端学习28个模块的420+门课程3000+节视频,涉及药品研发、注册、生产、质量等全生命周期,包括IPEM项目部分精华课程摘要,监管和学术机构专题教学和研讨会,及供应商技术介绍专业课程。除视频内搜索,收藏,评论功能外,部分原声视频实现双语...
|
|
FDA 对亚硝胺杂质检测先锋 Valisure 发出无标题信
2022.12.09
美国 FDA 在 12 月 6 日发布的一封给合同检测实验室 Valisure 的无标题信(Untitled Letter)中指出该公司未能遵守《药品供应链安全法案》(DSCSA),并且公司的分析检测实验室存在“方法学缺陷”。
根据 FDA 的说法,无标题信是向FDA已经认定违规但还没有严重到警告信级别...
|

|
FDA 对印度太阳药业发布进口禁令
2022.12.09
美国 FDA 于 12 月 7 日向太阳药业在印度 Halol 的工厂发出进口禁令,禁止从该工厂生产的产品发往美国市场。
根据 66-40 进口禁令的定义,“对于不符合药品 GMP 的企业出口到美国的药品,无需物理检查即可扣留”,在该工厂符合 FDA 标准之前,未来所有在 Halol 工厂生...
|
|
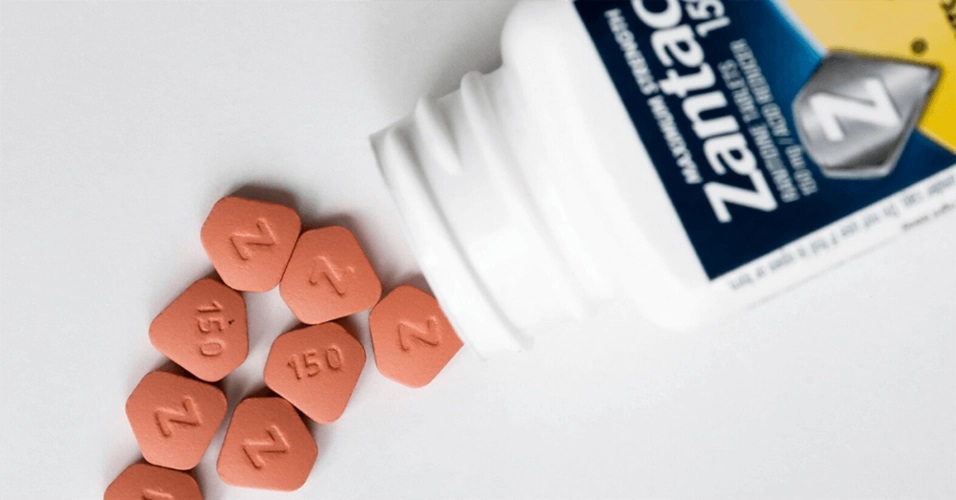
美联邦法院驳回对雷尼替丁致癌性的诉讼,缺乏科学证据...
2022.12.08
美国联邦法院最近对雷尼替丁(品牌名为 Zantac,善胃得)产品责任跨地区诉讼一案作出简易判决,裁定消费者的说法没有可靠的科学证据支持,赛诺菲、葛兰素史克(GSK)、辉瑞和勃林格殷格翰(BI)这几家大型制药商将从数千起声称善胃得胃灼热药物的致癌性诉讼中喘口气。
在 12 月 6 ...
|

|
FDA PD-1和PD-L1癌症免疫疗法替代给药方案指南定稿
2022.12.08
美国 FDA 于 12 月 6 日发布了“支持 PD-1 或 PD-L1 阻断抗体用于治疗癌症患者的替代给药方案的基于药代动力学的标准”定稿指南,帮助申办人寻求与根据原始临床疗效和安全性试验批准的当前静脉内给药方案不同的替代给药方案。
程序性细胞死亡受体1(PD-1)或程序性细胞死亡配体...
|

|
ICH 公布 Q13 连续制造定稿指南
2022.12.07
ICH 于 12 月 5 日公布了其 Q13《原料药与制剂的连续制造》指南最终采纳版本,定稿指南中,ICH 根据行业关于澄清受控状态和工艺动态的要求增加了相关内容。
ICH 于11 月下旬的 ICH 大会上就宣布已采纳 Q13 指南,但当时并没有发布。指南于 2021 年 7 月发布第三阶段草案...
|
|
FDA 时隔二十年更新建立生物等效性的统计学方法指南...
2022.12.07
美国 FDA 于 12 月 2 日发布了题为“建立生物等效性的统计学方法”的指南草案,更新了 FDA 评估研究用新药(IND)、新药申请(NDA)、简化新药申请(ANDA)以及对这些申请的补充申请中的体内或体外生物等效性(BE)的原则。
此次发布的更新指南草案取代了二十一年前 2001 年 ...
|

|
FDA 更新仿制药优先审评申报前设施通信指南草案
2022.12.06
美国 FDA 于 12 月 2 日发布了题为“ANDA:与优先仿制药申报相关申报前设施通信”指南草案,包含与简化新药申请(ANDA)审评项目中申报前设施通信(PFC)的内容、时间和评价相关的仿制药项目增强,这是仿制药使用者付费修正案重新授权(GDUFA III)的一部分。
最早在 GDUFA II...
|

|
国际药政每周概要:FDA 生物等效性统计方法指南,仿...
2022.12.06
【注册、审评、审批】
11.16【FDA】FDA 建模与仿真的成功与机遇
11.30【FDA】FDA 批准首个粪便微生物群产品
【创新研发与临床】
【GxP 与检查】
【CMC与仿制药】
12.02【FDA】指南草案 建立生物等效性的统计学方法
12.02【FDA】指南草案 ANDA:与优先仿制...
|

|
国内药政每周导读:MAH主体责任明确,注册电子申报落...
2022.12.05
【CMC药学研发与仿制药】
11.29,【药典会】 新增3篇化学药品、5篇通则标准草案的公示
【注册、审评与审批】
12.02,【CDE】关于药品注册申请电子申报有关要求的通知
【政策法规综合】
11.30,【NMPA】公开征求《药品上市许可持有人落实药品质量主体责任监督管理规定...
|

|
印度Lupin Limited各工厂近年警告信分析
2022.12.05
近年来印度Lupin公司成为了FDA警告信的常客,在三家印度工厂2017年和2019年收到警告信后,2021年,美国新泽西州的Novel Laboratories也收到了警告信。随后在今年9月,又一家印度原料药工厂(Lupin Limited MIDC)收到警告信。下表总结了Lupin各工厂近年来收到的警告信和其中所涉及的...
|

|
【周末杂谈】统计显著与临床意义
2022.12.04
从两例临床试验,看临床疗效量化表达的误导性
这周二,日本卫材和美国渤健两家药企合作的治疗阿尔茨海默病的单抗药Lecanemab的III期临床结果终于在《新英格兰医学杂志》和在美国旧金山举行的阿尔茨海默病临床试验大会面世了。在每两周给药10毫克、连续18个月给药的条件下,与安慰剂相比,...
|

|
【识林主题词】患者为中心PFDD,生物安全,注册受理与...
2022.12.03
— 主题词,是针对制药行业的关键概念,基于大量资料的综合分析,从定义、工作流程、法规指南、文献案例等多个维度梳理的系统知识纲要。
— 从主题词入手,也是使用识林的最佳方式之一。主题词的系统性、全面性和索引功能,既适合岗位新手快速入门,也适合老手随时备查。区别于散点化...
|

|
【识林解读与案例】细胞GMP,9-10月欧美批准,483综...
2022.12.03
在官方发布的法律法规、指导原则之外,识林原创、汇编、搜集了大量对比、解读、案例、解析等内容,作为识林用户学习法规指南的辅助,提供更多视角,且与岗位实务联系更为紧密。
这类资料,全部收录在刚刚开发的【对比解读案例解析】数据库内(点击查看使用介绍),通过“业务标签”和“...
|

|
FDA 和美国国家标准与技术研究院合作对单克隆抗体和...
2022.12.02
美国 FDA 和国家标准与技术研究院(NIST)最近宣布正在合作开展一个项目,以开发和协调用于标准化单克隆抗体(mAb)和其它用于疫苗和治疗的生物大分子的温度敏感性和稳定性描述的方法。
FDA_和美国国家标准与技术研究院合作对单克隆抗体和大生物分子的稳定性进行基准测试和分析.jpgthu...
|
|
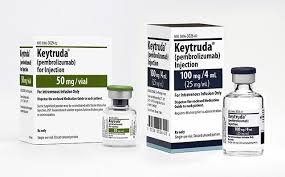
默沙东起诉约翰霍普金斯大学违反合同非法取得 K 药...
2022.12.02
美国默沙东公司于 11 月 29 日在马里兰州联邦法院对约翰霍普金斯大学(JHU)提起诉讼,声称大学在与公司就有关重磅抗癌药 Keytruda(帕博利珠单抗,K药)的研究合作中获得非法专利。
默沙东称,约翰霍普金斯大学秘密获得并许可了与 Keytruda 相关的专利,同时大学还声称 Keytru...
|

|
渤健卫材阿尔茨海默新药详细数据发布,希望与问题相伴
2022.12.01
11 月 29 日,渤健和其合作伙伴卫材在阿尔茨海默病临床试验大会上介绍了其备受关注的研究性阿尔茨海默药 lecanemab 的详细 3 期临床数据,这一数据同时在《新英格兰医学杂志》(NEJM)上发表1。
专家表示卫材在会议上的演讲或许打消了人们对于 lecanemab 是否能成功的担忧,同...
|

|
加速批准缓慢撤销:一款局部抗菌药经过 24 年才得以...
2022.12.01
美国 FDA 于 11 月 29 日宣布,美国最大的仿制药企业 Viatris(前身是 Mylan 和辉瑞普强)已决定撤回局部抗菌剂 Sulfamylon(醋酸磺胺米隆),此时距离该药加速批准已经过去了 24 年。
根据 FDA 在联邦公报上发布的通告,1998 年 6 月 5 日,FDA 根据加速审批规定批准了...
|