
|
欧盟官员表示 ICH Q6B 生物制品检测方法和可接受标...
2021.12.07
瑞典医疗产品管理局疫苗和单克隆抗体(MAb)高级专家 Mats Welin 在 2021 年 11 月 30 日由国际制药工程协会(ISPE)主办的关于以患者为中心的质量标准网络研讨会上表示,ICH Q6B《质量标准:生物技术产品及生物制品的检验方法和接受标准》设定了新生物制品的可接受标准,需要修...
|

|
国内药政每周导读 2021.11.29-12.05
2021.12.06
11.30,广东省局发布《药品上市后注册管理事项变更备案有关事宜》的通告
11.30,NMPA发布《麻醉药品和精神药品进出口准许证申报资料要求》
12.01,GVP《药物警戒质量管理规范》正式实施
12.01,NMPA就《药物警戒检查指导原则》公开征求意见
12.02,NMPA批准临床急需罕...
|

|
吐温 80 中的脂肪酸组成对治疗性蛋白质制剂稳定性的...
2021.12.06
聚山梨醇酯(吐温)辅料通常用作表面活性剂以稳定制剂中的治疗性蛋白质。吐温的降解可能导致药物制剂的颗粒形成和不稳定性。美国 FDA 药品审评与研究中心(CDER)以及食品安全和应用营养中心(CFSAN)的科学家们于 11 月 29 日发表在美国药学科学家协会(AAPS)期刊《药物研究》上的...
|

|
【周末杂谈】科学监管与公众信任
2021.12.05
科学监管重要,让公众感觉到科学监管同样重要
QA中的A代表Assurance。曾负责FDA GMP运行的Nick Buhay先生曾解释如下。与guarantee(保证)不同,assurance有“尽了最大努力”的意思。Assurance是针对过程,而guarantee是针对结果。FDA难以“保证”药品的质量,只能做到尽最大努力去监...
|

|
辉瑞新冠疫苗全部审评资料公开需要多久时间?FDA 表...
2021.12.04
上个月,一条美国 FDA 需要 55 年的时间才能完全公开辉瑞新冠疫苗审评资料的新闻在美国被热议,尤其是在社交媒体圈内,大约类似于在国内上了热搜。那么事情究竟是怎样的呢?
美国透明度公共卫生和医疗专业人员组织通过《信息自由法案》(FOIA)请求 FDA 提供支持辉瑞新冠疫苗许可...
|

|
识林新功能发布:【页面比对】【未读高亮】
2021.12.03
识林【页面比对】:在线花脸稿对比工具
— 你可直接观看录屏,最直观了解新功能的用法和特色:
link=13px 1)【识林】识林使用 - 页面比对:简介和入口
w640h400acenter
link=13px 2)【识林】识林使用 - 页面比对:全文比对
w640h400acenter
link...
|

|
FDA 概述 2022 财年仿制药研究重点,关注复杂仿制...
2021.12.03
美国 FDA 根据利益相关者在 2021 年 6 月 23 日举行的公开会议上的反馈以及收到的关于在该会议上宣布的 15 项拟议研究重点的书面反馈,发布了 2022 财年具体仿制药研究重点的修订大纲。
口服吸入产品也存在各种药代动力学和药效学建模挑战,根据反馈意见,FDA 对 2022 财...
|

|
【识林主题词】新增:偏差调查、无进展生存期、客观缓...
2021.12.02
什么是识林主题词?
— 主题词是识林产出的知识,源于对大量法规、文献、案例、问答的综合分析,并从概述/概述、法规指南、实施指导、视频、问答、案例、参考资料等多维度呈现。
— 区别于散点化的法规和技术资料,主题词是精炼沉淀的知识,目的是帮助识林用户系统学习,全面了...
|

|
国际药政每周概要:2021.11.22-11.28
2021.11.30
11.22 FDA 检查监督弹性路线图更新
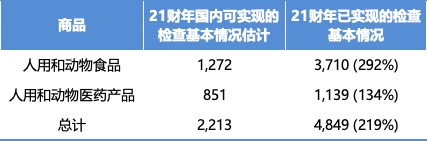
FDA 在更新的路线图中表示其在 2021 财年下半年进行的国内监督检查数量是最初在春天发布的路线图中预测数量的两倍多。FDA 预计到 2021 财年末可以执行 2,213 次检查,但 FDA 已经设法执行了 4,849 次检查。
在批准前检查方面,截至 202...
|

|
FDA 发布使用登记数据支持监管决策的指南草案
2021.11.30
美国 FDA 于 2021 年 11 月 29 日发布了指南草案《真实世界数据:评价登记以支持药品和生物制品的监管决策》。该指南草案为申办人和其他利益相关者在设计登记(registry)或拟议使用现有登记来支持有关药品有效性或安全性的监管决策时提供了考虑因素。
该指南涵盖的主题包括:...
|

|
识林会议日历双周预告20211130 - 1218
2021.11.29
识林会议日历
会议是医药产业学习的关键途径之一。会议数量太多,质量参差不齐,没有实时更新提醒的平台,经常会错过一个好会、或在一个不好的会耽误时间,并无处吐槽。
识林会议日历,专门搜集国内外有专业声誉和影响力的会议日程,梳理详细信息和原始链接,并提供评分和评价功能...
|

|
国内药政每周导读 2021.11.22-11.28
2021.11.29
11.23,广东省人民政府办公厅关于印发《广东省全面加强药品监管能力建设若干措施》的通知
11.23,CDE,CFDI,山东局发布多条官方问答
11.23,CDE公开司美格鲁肽注射液上市技术审评报告
11.25,NMPA附条件批准奥雷巴替尼片,恩沃利单抗注射液,批准植入式左心室辅助系...
|

|
【周末杂谈】专业知识+交流能力+干劲
2021.11.28
一位协助国产新冠疫苗通过世卫组织GMP检查的专业人士
从事无菌产品生产的人都知道在生产前设备装机时要注意无菌性,但不是所有人都知道在生产完后拆机时也要注意无菌性,也许更少的人知道为什么。
GMP不是产品注册申报材料的一部分,但做好GMP离不开对产品和工艺的了解,这已是常识...
|

|
ICH 2021 年 11 月大会公布最新指南进展和下一步...
2021.11.27
ICH 大会于 11 月 17 日至 18 日通过网络召开,会议之前是 ICH 管理委员会和 MedDRA 管理委员会网络会议。
大会上 ICH 进一步扩大了会员和观察员。墨西哥 COFEPRIS 成为新的 ICH 成员,此外还有三个新的 ICH 观察员:埃及 EDA,印度尼西亚 FDA 以及乌克兰 SECMOH。目前...
|

|
ICH 正修订 E2D 上市后安全数据管理指南,协调处理...
2021.11.26
ICH 正在准备更新 E2D《上市后安全数据管理》指南,帮助公司处理来自越来越多来源的批准后安全数据。
ICH E2D(R1) 专家工作组报告员、AbbVie 卓越药物警戒副总裁 Vicki Edwards 在 10 月初 DIA 药物警戒受权人(QPPV)论坛上表示,正在考虑采取多种方法更新关于批准后安全数...
|

|
研究显示真实世界数据尚未准备好替代批准后确证性试验
2021.11.26
对于获得加速批准的药物和生物制品,从真实世界数据源中提取的信息能否取代传统的批准后临床试验以确认这些治疗产品的获益?最近一项研究指出,真实世界数据(RWD)还不足以确证基于替代终点获得加速批准的药物的获益。
耶鲁大学公共卫生学院环境健康科学系的 Joshua Wallach 及合著者在...
|
|
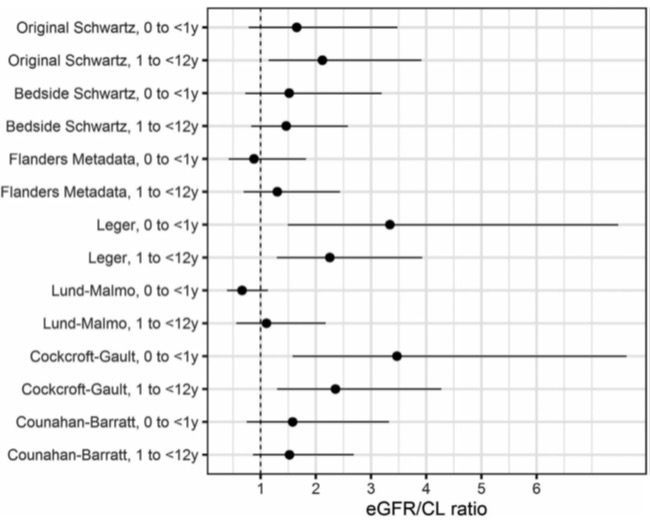
FDA 监管科学研究:通过调整肾功能评估改善儿科药物...
2021.11.25
剂量选择是儿科药物开发中的一项重大挑战;常用的肾功能方程会高估肾小球滤过率,导致对药物清除的预测不准确。
FDA 于 2021 年 11 月 23 日在 Regulatory Science in Action 板块发布的一篇文章中,FDA 药品审评与研究中心(CDER)的科学家分享了有关调整估算肾小球滤过率(...
|
|
FDA 表示 2021 财年检查数量远超预期
2021.11.24
美国 FDA 于 2021 年 11 月 22 日更新了《FDA 检查监督弹性路线图》,表示其在 2021 财年下半年进行的国内监督检查数量是最初在春天发布的路线图中预测数量的两倍多。
在最初路线图中,FDA 估计在 2020 财年和 2021 财年计划完成的 15,000 多项国内监督检查会因大流...
|
|
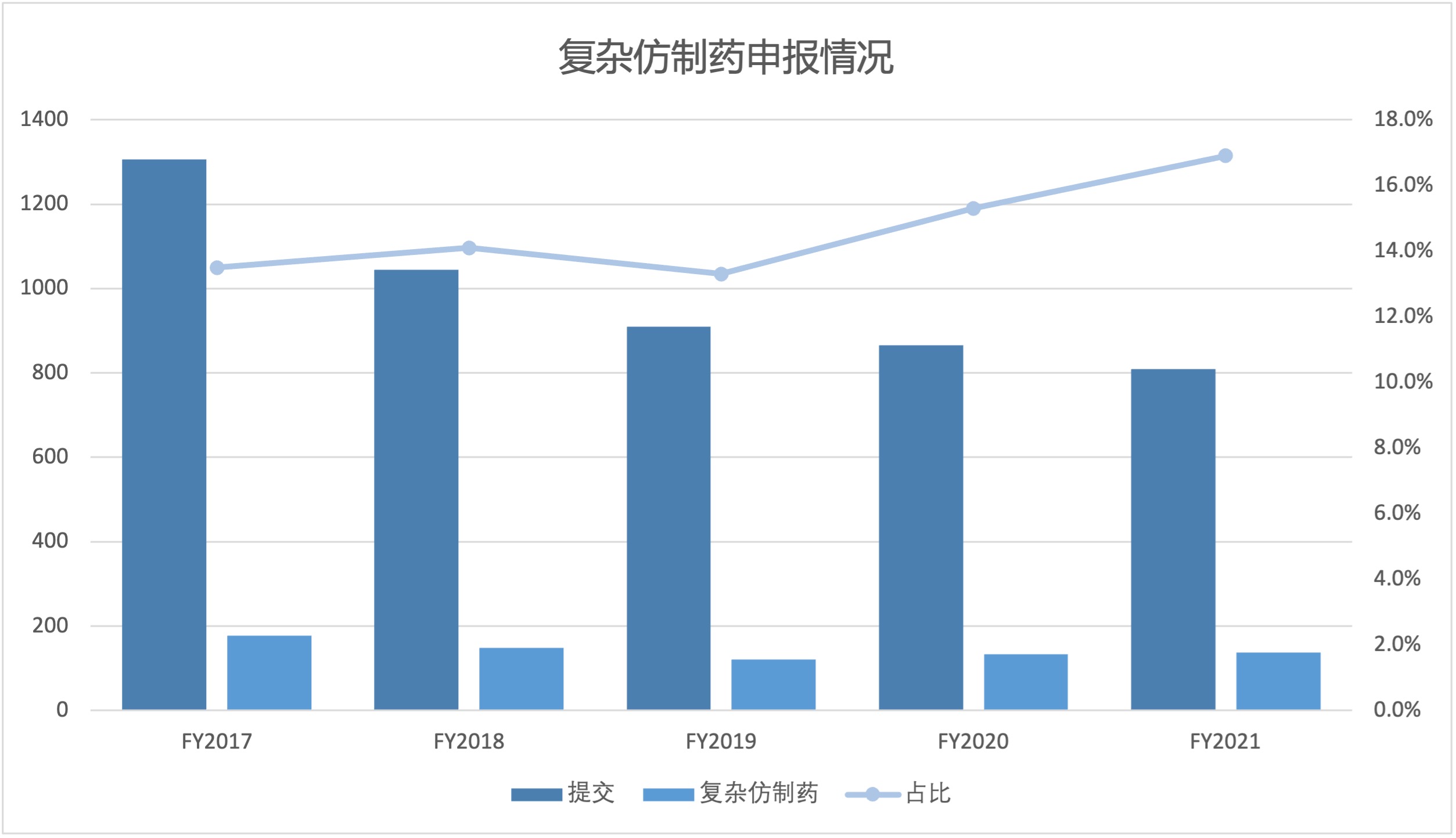
FDA 复杂仿制药申请日益增长,需分配更多审评资源
2021.11.24
2021 财年,美国 FDA 复杂仿制药批准占所有简化新药申请(ANDA)批准的 13% 以上,自 2017 财年以来,复杂仿制药批准呈稳步增长趋势。随着复杂产品申请份额逐渐增加,FDA 可能需要调整其内部人员配备和其它资源来适应变化。
美国 FDA 仿制药办公室(OGD)研究与标准办公室 Robert L...
|

|
国际药政每周概要 2021.11.15-11.21
2021.11.23
11.15 FDA 发布2010年1月至2017年6月美国 FDA 批准上市的首仿药研究报告
研究报告审查了 FDA 从 2010 年到 2017 年年中批准的 687 个首仿药,以评估首仿药上市的速度。基本假设是 180 天专营权承诺不仅会激励仿制药制造商争夺首仿药的地位和挑战专利,而且还会激励这些...
|