
|
【一周回顾】2021.11.01-11.07
2021.11.08
国家局启用原料药生产供应信息采集模块、短缺药品生产供应及停产报告信息采集模块。药审中心公开征求审评计时中止与恢复管理规范的意见,征求 ICH E14 及问答和 Q3C(R8) 指导原则的实施建议。英国批准首个新冠口服抗病毒药物。WHO 发布第八种新冠疫苗的紧急使用清单。
上周热...
|
|
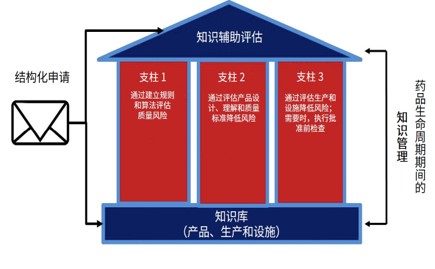
FDA 将逐步扩大 KASA 审评计划的使用,正在开发生...
2021.11.08
美国 FDA 正采取“逐步”方法来实施其知识辅助评价和结构化评价(KASA)药品审评计划。该审评计划已针对固体口服制剂的简化新药申请(ANDA)启动,最终将在 2023 财年针对新药申请(NDA)和 ANDA 液体制剂推出。
KASA 将在 2024 年分阶段用于研究用新药申请(IND)和批准后变更,...
|

|
【质量对话】生产质量管理领域的专业化
2021.11.07
要赢得他人在专业上的尊重,首先需要有值得尊重的思想和做法
刺槐: 对药企尤其是创新型药企来说,生产和质量的重要性,恐怕是要排在营销和研发后面,而质量又排在生产后面,垫底。
编辑: 不是常听企业说“质量重于山”吗?
刺槐: 是的,都是这么“说”的。记得几年前,在一...
|

|
默沙东口服抗新冠药 Molnupiravir 首获英国授权,作...
2021.11.05
2021 年 11 月 4 日,英国对迄今为止首个显示成功治疗新冠的药物默沙东的 Molnupiravir 授予有条件许可,成为首个许可该药的国家。
该药在英国获准用于 18 岁及以上新冠检测呈阳性并且至少有一种患严重疾病的风险因素(例如,肥胖或心脏病)。轻度至中度新冠患者需要服用四片...
|

|
研究人员举报辉瑞新冠疫苗试验数据可靠性问题,FDA ...
2021.11.05
2021 年 11 月 2 日发表在英国医学杂志(BMJ)上的一篇调查文章1备受关注,文章报告了内部举报人对帮助开展辉瑞关键新冠疫苗试验的合同研究公司的不良做法的揭露,引发了人们对于数据完整性和 FDA 监管监督有效性的担忧。
文章的信息来自于研究组织 Ventavia 研究集团的一名地...
|

|
FDA 新兴技术计划进击 2.0,计划增加人员并纳入技...
2021.11.04
美国 FDA 为进一步加速新制药技术的采纳,药品审评与研究中心(CDER)正在为其新兴技术计划增加人员,并逐步将新技术探索“毕业”推进到标准质量评价路径中。
2021 年 10 月 27 日,新兴技术计划(ETP)负责人 Larry Lee 在 FDA 药品质量网络研讨会上表示,这些变化是“创...
|

|
FDA 发布 GDUFA III 承诺函,增加对适用性请愿和...
2021.11.04
随着仿制药使用者付费修正案第三次迭代(GDUFA III)谈判的完成,美国 FDA 公布了其承诺函,其中列出了绩效目标和计划的改进。
GDUFA III 承诺函几乎是五年多前发布的 GDUFA II 期承诺函的两倍。FDA 在承诺函中写道,“该计划的新改进旨在最大限度地提高每个审评周期的效率和...
|

|
FDA 强调亚硝胺检测应符合目的并需交叉检查
2021.11.03
2021 年 10 月 27 日,在美国 FDA 药品审评与研究中心(CDER)小企业和工业援助(SBIA)主办的药品质量网络研讨会上,FDA 复杂药物分析部门主管 Jason Rodriguez 表示,制药商应确保他们使用的分析检测“符合目标要求(fit for purpose)”,以确保在检测药物的亚硝胺时正确...
|
|
美国政府审查报告证实新冠疫苗生产场地在获得授权之前...
2021.11.03
一直关注识林的读者可能还记得,去年 12 月份我们就曾讨论过 FDA 授权新冠疫苗之前并没有做批准前检查。现在美国政府的官方报告数据出来了,没做批准前检查是确定的,而其中的一些原液和重要辅料工厂甚至从未接受过 FDA 的检查。
美国政府问责办公室(GAO)在一份最新的报告中表...
|

|
美国卫生部强迫制药商提供药价折扣,法院裁定政府违规
2021.11.02
法律面前人人平等,一周前识林报道了 FDA 好心做好事,但被判违法。今天我们来看看另一桩美国制药业取得胜利的官司。
美国一名联邦法院法官裁定美国政府对制药业的行为不正确,那么是什么行为呢,是先前美国政府因礼来和其他几家制药商终止向医院和诊所就主要针对低收入人群的药品提...
|

|
【一周回顾】2021.10.25-10.31
2021.11.01
欧盟发布检查和信息交换程序汇编更新。美国、英国和加拿大监管机构合作制定机器学习质量规范。美国 FDA 紧急使用授权辉瑞-BioNTech 新冠疫苗用于 5 至 11 岁儿童。FDA 公布多篇警告信和 483。
上周热点资讯:
【周末杂谈】大洋彼岸仿制药业的惨境
FDA 向一家医院和两...
|

|
FDA 启动药品产量报告门户网站并发布相关指南
2021.11.01
美国 FDA 于 10 月 29 日启动了新的 NextGen 门户网站,用于根据《冠状病毒援助、救济和经济安全法案》(CARES 法案)报告药品和生物制品的产量数据,并随之发布了两份指南(指南1;指南2)帮助注册人遵守法规与报告要求。
门户网站和相关指南是在 FDA 于 2020 年 8 月...
|

|
【周末杂谈】大洋彼岸仿制药业的惨境
2021.10.31
仿制药在节省药费上贡献巨大,何不将部分节省下来的钱用来奖励仿制药业?
9月份美国FDA批准了42个仿制药注册申请(ANDA),其中包括3个意向性批准。这是过去6年来最低的一次。比较一下:2020年总共批准了948个ANDA,平均每个月79个。虽然2018年2月的批准数目低达37个,但那是受沙坦类产...
|

|
行业组织就 ICH Q12 实施细节向 FDA 提交反馈意...
2021.10.30
国际制药工程协会(ISPE)正在呼吁美国 FDA 对 ICH Q12 批准后变更指南进行多处修订。FDA 于今年 5 月发布 Q12 实施考量指南草案并公开征求意见。
ISPE 在其 10 月 8 日的反馈意见中提出,拟议报告类别应放在通用技术文件(CTD)的区域性信息部分,而不是模块 3 中。ISP...
|

|
欧盟更新检查和信息交换程序汇编,梳理检查程序和配套...
2021.10.28
欧盟于 2021 年 10 月 26 日公布了其《欧盟检查和信息交换程序汇编》更新版本,对汇编中涉及的文件进行了大幅修订和更新。
汇编以前被称为《行政协作和检查协调的共同体程序汇编》,是促进欧盟成员国 GMP 和 GDP 检查员之间合作的工具和实现协调的手段。其中程序为构成国家 G...
|

|
美加英三国联合发布医疗器械开发机器学习质量规范十项...
2021.10.28
美国 FDA、加拿大卫生部(HC)以及英国 MHRA 共同确定了 10 项指导原则,为机器学习质量管理规范(Good Machine Learning Practice,GMLP)的制定提供指导pdf。这些指导原则将有助于推广使用人工智能和机器学习(AI/ML)的安全、有效和高质量的医疗器械。
人工智能和机器学习...
|

|
监管专家谈细胞治疗产品
2021.10.27
2021年10月14日,“第五届中国药品监管科学大会 — 细胞治疗产品开发与监管分论坛”召开。分论坛云集了16位来自学术界、产业界和监管机构的专家,就细胞治疗产品的研发现状、全球监管、国内注册审评/检验/GMP生产管理展开讲座。
继今年6月,国内首个细胞治疗产品(CAR-T) — 复...
|

|
FDA 鼓励行业采用建模工具确保工艺过程稳定
2021.10.27
美国 FDA 鼓励制药行业采用先进工艺控制(APC)建模工具来确保生产工艺在受控状态下运行,并表示,这些工艺通常是被动监控而不是主动受控。
FDA 药品制造评价办公室主任 Stelios Tsinontides 在美国药学科学家协会(AAPS)PharmSci 360 会议的预录制视频上表示,“我们的过程能力...
|

|
FDA 警告三家美国企业火灾影响调查不足,无视记录索...
2021.10.26
美国 FDA 于 10 月 19 日对美国非处方药(OTC)制药商、成品药制造商以及原料药(API)制造商分别发出了警告信,主要缺陷涉及对合同制造商(CMO)的监督不力、未能解决火灾如何影响 API 成分的质量以及无视 FDA 对企业电子记录的索要请求。
这三家企业分别是位于密苏里州的 API ...
|

|
FDA 向一家医院和两名医生发出警告信,违反人类研究...
2021.10.26
美国 FDA 最近公布了两封警告信,严厉警告明尼苏达州一家医院及其两名医生违反人类研究规定,在急诊室或在患者到达急诊室之前对患者进行精神病药物和强效麻醉剂氯胺酮的测试。
警告信在其检查员发现 Hennepin 医疗中心及其医生未能获得参与涉及管理躁动的药物的安全性和有效性试验...
|