
|
【周末杂谈】FDA 好心做好事,但被判违法
2021.10.24
法律面前人人平等,企业与FDA也平等,不论企业是贪心还是良心挣钱
9月30日,美国联邦上诉法院判定FDA一项孤儿药的批准违法,并用了较为严厉的词句:“FDA的批准是随意的(arbitrary),任性的(capricious)和违法的。这个案子一直备受业界关注,此前联邦法院曾判FDA胜诉。FDA尚有一次...
|

|
FDA 发布申报资料中真实世界数据的数据标准指南草案
2021.10.23
上周末识林的“质量对话”栏目中探讨了数据质量的问题,提到了对数据的明确和统一定义的问题。这周美国 FDA 就发布了新的指南草案来解决数据标准化的问题。FDA 于 10 月 21 日发布《包含真实世界数据的药品和生物制品提交数据标准》指南草案,提供了从索赔或电子健康记录(EHR)来...
|

|
FDA 发布 OTC 助听器拟议规定
2021.10.22
美国 FDA 于 2021 年 10 月 20 日发布了一项美国公众期待已久的拟议规定,创建一个新的监管类别,允许向轻度和中度听力损失的成年人销售非处方(OTC)助听器。
2017 年《FDA 重新授权法案》的一项条款通过了 2017《非处方助听器法案》,确立了实施拟议规定的要求。该法案指示 FD...
|

|
英国推出新的临床试验自动注册系统
2021.10.22
英国政府宣布将自动在一个独立的注册机构登记新的研究,此举旨在减少对企业、大学和研究人员执行最新注册登记的依赖。
这项工作将于 2022 年 1 月开始,作为英国卫生研究局(HRA)和 ISRCTN 合作伙伴关系的其中一项任务。ISRCTN 是位于伦敦的注册机构,是 WHO 全球认可的试验...
|

|
阿尔茨海默新药批准的误解:听听参与 FDA 审评的王...
2021.10.21
过去一年中,识林对在美国获批的首个阿尔茨海默新药 Aduhelm(aducanumab)进行了跟踪报道,从专家会意见,FDA 的批准决定及说明,到专家成员反对批准而辞职、众议院对批准的质询以及联邦监察机构的审查行动,这个药聚焦了各界对其的希望、失望、赞扬与批评。FDA 也先后公布了详细的...
|
|
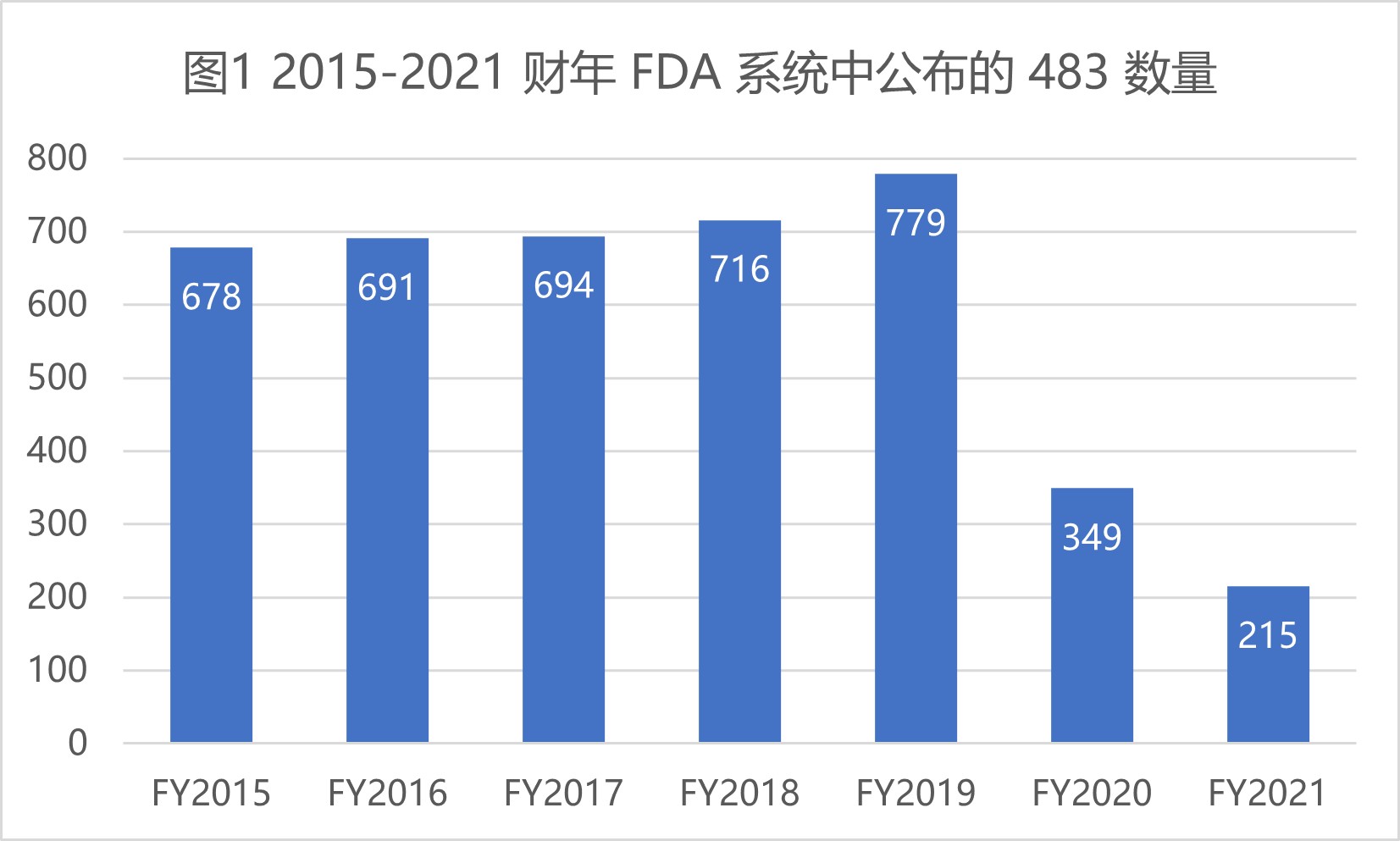
FDA 2021 财年药品检查观察项和趋势
2021.10.21
美国 FDA 于 2021 年 10 月 18 日最新发布了 2021 财年检查观察项汇总数据,本文重点查看药品制剂方面的 483 相关缺陷数据。
由于新冠疫情继续在世界绝大多数国家和地区肆虐,2021 财年 FDA 执行的检查数量仍然有限,而且执行的检查大多也是针对关键任务,涵盖面有限。所以...
|

|
免费线上讲座:如何准备生物原液(DS)的 FDA 检查
2021.10.20
link=13px
【识林】如何准备生物原液(DS)的 FDA 检查 2021.10
w640h400acenter
国内生物创新药的蓬勃发展,持续稳定的为患者提供质量可靠的产品是最终目标,尤其对尝试国际市场的创新药,FDA 检查是关键环节。识林联合 IPEM 教育项目,邀请 FDA 无菌指南主要作者,微...
|
|
欧盟警告对二氧化钛辅料采取行动将导致严重药物短缺
2021.10.20
欧洲药品管理局(EMA)发现,要求制药商替换药品中的二氧化钛(TiO2)“几乎肯定会导致严重的药品短缺和停产/撤销 …… 对患者和动物产生重大影响。”
EMA 应欧盟委员会的要求调查了逐步停止使用二氧化钛辅料的影响。该委员会的要求是由欧洲食品安全局(EFSA)提出的一项建议引发的。E...
|

|
FDA 批准首个阿达木单抗可互换生物制品,为转换研究...
2021.10.19
美国 FDA 于 2021 年 10 月 15 日批准了首个阿达木单抗可互换生物类似药 Cyltezo(阿达木单抗-adbm)用于治疗某些炎症性疾病。Cyltezo 与修美乐(Humira)生物类似并可互换。Cyltezo 也是 FDA 批准的第二款可互换生物制品,最初于 2017 年 8 月 25 日被许可为 Humira 的生...
|

|
强生新子公司申请滑石粉破产,原告对这一策略提出质疑
2021.10.19
强生公司已为其新成立的子公司 LTL Management 申请破产保护,以管理大量指控其滑石粉产品致癌的诉讼。这一策略识林在之前 7 月份已经有过相关报道:【强生或考虑“两步破产”以解决数十亿美元的婴儿爽身粉诉讼债务 2021/07/20】
但原告并不买账。代表 3 万多名提出索赔的女...
|

|
【一周回顾】2021.10.11-10.17
2021.10.18
药审中心就罕见疾病药物临床研发技术指导原则公开征求意见。美国 FDA 发布 ICH Q13 原料药与制剂的连续制造指南征求意见稿,FDA 将召开专家会讨论默沙东和 Ridgeback 的新冠口服治疗药的 EUA 申请。欧盟发布 2021 年年中报告。
上周热点资讯:
ICH 发布 E8(R1) 临床研...
|

|
【质量对话】基于数据与数据驱动
2021.10.17
从数据的相关性和可靠性,看数据的质量
刺槐:垃圾进,垃圾出(Garbage In, Garbage Out, GIGO),众所周知。虽然也不时有人从垃圾中发现宝物,但这是小概率事件。大概率事件是数据的质量决定了结果的质量。最近的两篇识林报道从临床数据【FDA 发布电子健康记录和医疗索赔数据中...
|

|
FDA 继续大力推进先进制造计划
2021.10.16
患有囊性纤维化、HIV、乳腺癌、白血病和哮喘等疾病的患者正受益于以更新、更方便、更灵活的方式制造的药物。这是因为某些药物制造商采用了先进制造:创新和新兴的药物生产方法。
从广泛的公共卫生角度来看,先进制造业是美国整体战略的关键组成部分,旨在加强国内药品制造并增加国内为...
|

|
ICH Q9 质量风险管理指南修订将推迟三个月,解决风...
2021.10.15
ICH Q9《质量风险管理》指南的修订由于新冠疫情已推迟了大约三个月,但修订过程仍在继续推进。
爱尔兰卫生产品监管局高级 GMP 检查员 Kevin O'Donnell 在 9 月 30 日的 PDA/FDA 联合监管会议上表示,这将是“非常有针对性的修订。我们不会修改指南的许多方面,这绝不是完...
|

|
十个月后 FDA 正式局长提名终于浮出水面?
2021.10.15
美国 FDA 正式局长的空缺已长达 10 个月,这在很大程度上要归咎于参议院的确认程序。主要民主党人对既有所有潜在的 FDA 局长候选人都公开表达了不满,包括目前担任 FDA 代理局长并且长期担任 FDA 资深领导的 Janet Woodcock。
据《华盛顿邮报》报道,拜登政府正在审查目前在谷歌 ...
|

|
国际药监机构联盟讨论生产变更管理中监管灵活性的先决...
2021.10.14
根据国际药品监管机构联盟(ICMRA)最新发布的一份声明 pdf以及会议录像,在 7 月份的研讨会上,监管机构和行业代表表示,与行业的频繁沟通以及依赖其他监管机构的评估,使新冠疫苗和治疗药的快速扩大规模成为可能。
研讨会探讨了在新冠疫情期间如何部署不同的监管工具来提高疫苗的...
|

|
FDA 发布关于 Moderna 和杨森新冠疫苗加强针的专家...
2021.10.14
美国 FDA 将于 10 月 14 - 15 日两天召开专家会讨论并投票表决是否应授权 Moderna 和杨森新冠疫苗的加强针 EUA。FDA 已公布了部分会前资料,文件列出了授权两款加强针的理由,但也指出,数据到目前为止还不清楚是否需要第三针。
FDA 科学家在 Moderna 疫苗的简报文件中...
|
|
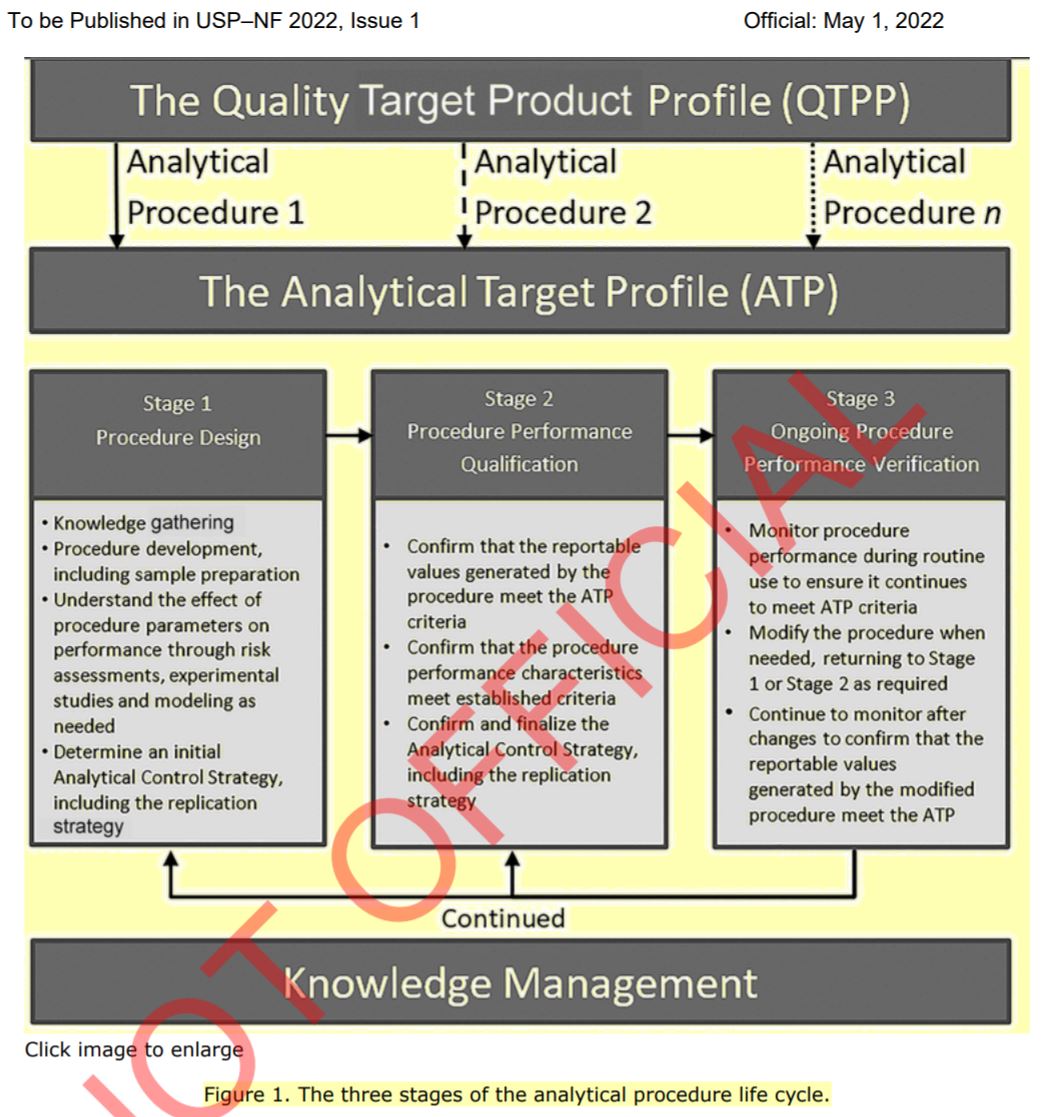
新 USP 通则章节详述分析检验的生命周期方法
2021.10.13
美国药典(USP)最近发布了新的第 1220 章的过程。这一章节将于 2022 年 5 月 1 日正式生效。
USP 章节补充了 ICH 正在制定的 Q14 指南,Q14 有望让制药商更容易的转换分析方法来检测药物。【ICH Q14 分析方法开发草案将于明年初发布,关键信息有哪些?2020/06/25】
...
|

|
美国政府激励扩大一次性疫苗和药品生产系统的国内产能
2021.10.13
美国生物医学高级研究与发展局(BARDA)于 9 月 30 日授予新泽西州 Lebanon 的 FlexBiosys 公司一笔 1450 万美元的合同,该供应商将使用这笔资金扩建其制造工厂,以“为新冠和与疫情相关的一次性产品提供增强的国内制造能力。” 10 月 7 日,BARDA 宣布征求有关政府出资扩...
|

|
ICH 发布 E8(R1) 临床研究的一般考虑指南
2021.10.12
ICH 于 10 月 6 日宣布,E8(R1)《临床研究的一般考虑因素》指南已达到第 4 阶段,正在等待各监管机构批准采纳。这份广受期待的指南通过采用质量源于设计的原则,使临床试验的设计、实施和报告现代化。指南结合了“实现符合预期目的的数据质量的当前概念。”
ICH 表示,“ICH E...
|