
|
FDA 发布疫情期间仿制药研发和申报问答指南
2021.04.07
美国 FDA 于 4 月 5 日发布了针对仿制药生产商的新问答指南,以解决新冠(COVID-19)公共卫生紧急事件期间仿制药开发以及简化新药申请(ANDA)申报和评价相关问题。
FDA 表示,“FDA 认识到 COVID-19 公共卫生紧急事件可能会影响仿制药产品的开发,中断或延迟 ANDA 申请...
|

|
欧盟官员首次表示阿斯利康新冠疫苗与罕见血栓事件之间...
2021.04.07
欧洲药品管理局(EMA)的一名官员于 4 月 6 日首次承认阿斯利康/牛津大学新冠疫苗与疫苗接受者中罕见血栓之间存在联系。但他表示接种疫苗的获益仍超出风险。
据路透社报道,随着血栓报告数量的增加,EMA 疫苗负责人 Marco Cavaleri 对意大利报纸 il Messaggero 表示,“我...
|

|
FDA 新药审批收紧?Nuplazid 扩大痴呆及阿尔茨海默...
2021.04.06
Acadia 制药公司于 4 月 5 日表示,美国 FDA 拒绝了其对抗精神病药 Nuplazid(酒石酸哌马色林)寻求治疗广泛痴呆症相关的精神病(DRP)患者(包括阿尔茨海默症和其它疾病)的幻觉和妄想的补充新药申请(sNDA)。FDA 的拒绝理由是“在某些痴呆亚组中缺乏统计学意义”并且“对某些...
|

|
FDA 公布新冠应对五大重点,探索远程检查改革紧急使...
2021.04.06
美国 FDA 于 4 月 2 日发布了有关新冠大流行恢复和应对计划(PREPP)倡议的更新报告,表示将努力改善大流行应对的五个方面,以使 FDA 在当前和未来的公共卫生紧急情况中更具灵活性。
FDA 代理局长 Janet Woodcock 表示,“随着我们持续应对新冠疫情,至关重要的是,我们必...
|

|
【一周回顾】2021.03.29-04.04
2021.04.05
WHO 发布多篇指南定稿,包括数据可靠性、制药用水和共线生产清洁验证残留限度等。药审中心发布药物免疫原性研究技术指南以及纳米药物相关指南。FDA 批准首个多发性骨髓瘤 CAR-T 疗法。APIC 发布原料药工厂清洁验证指南。识林案例解析新发布治疗用单抗表征和可开发性评估。
上周...
|
|
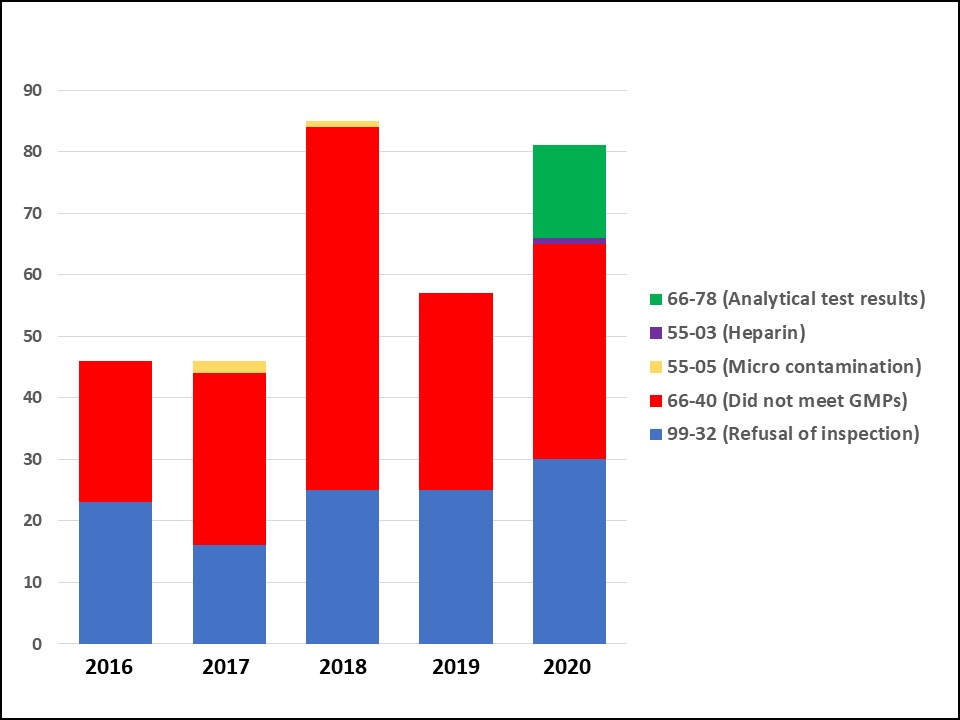
FDA 合规办公室 2020 年报:检查减少,警告信增多
2021.04.05
根据美国 FDA 近期发布的《2020 年合规办公室年度报告》,FDA 药品审评与研究中心(CDER)合规办公室(OC)在 2020 年,由于新冠疫情,检查工作减少,但警告信却有所增多,进口禁令数量也有所增加。
报告还重点介绍了 2020 下半年在办公室活动中占主导地位的新冠应对,包括:保...
|

|
【周末杂谈】废除 FDA
2021.04.04
政府的作用是保护权利并防止欺诈,而不是防止人们做出冒险的选择
在药业,FDA有着神圣的地位。科学理性监管,保护和促进公众健康,似乎是FDA的代名词。不知这是因为听得多了,习以为常了,还是经过深思熟虑后体会出来的。但不管怎样,听听相反的意见,哪怕是偶尔听听,也许不是坏事。美...
|

|
【识林专论】从消费者健康需求表达角度出发提高医疗健...
2021.04.03
【编者按】以此篇“从消费者健康需求表达角度出发提高医疗健康系统效率”为首刊文章,识林资讯开启“识林专论”栏目,专刊对生物医药领域一些普遍关注问题的特色性思考和讨论的文章。此为不定期专栏,设在周六,但非每周六都有刊出。欢迎大家关注、参与讨论、提建议及投稿。祝大家周末愉...
|

|
三名专家小组成员公开发文呼吁 FDA 拒绝渤健阿尔茨...
2021.04.02
美国 FDA 的专家会制度通常是 FDA 召集药品或疫苗咨询委员会,10 余位外部专家提出他们的看法并就 FDA 设定的投票问题投票,然后 FDA 可以选择听取或不听取专家会的意见。【周末杂谈:从FDA专家会,想我国药业发展】但渤健(Biogen)阿尔茨海默药 aducanumab 的专家会和审评过...
|

|
FDA 被举报检查结果不当降级,默沙东疫苗工厂存在严...
2021.04.02
一名前美国 FDA 检查员举报 FDA 对一系列制药商的违规行为从轻处罚,其中涉及位于北卡罗来纳州 Durham 市的默沙东公司疫苗工厂。
在调查了举报人的指控后,特别检察官办公室(OSC)在周三给美国总统拜登的信中详细说明了这些指控。尽管举报人对 FDA 在几家工厂的违规行为表示担...
|

|
WHO 发布制药用水 GMP 定稿指南,从防止污染到最大...
2021.04.01
WHO 于 3 月 29 日发布了其第 55 届药物制剂规范专家委员会(ECSPP)技术报告 1033(TRS 1033),定稿了大批指南和规范,昨日我们介绍了《数据可靠性指南》和《清洁验证中包括基于健康的暴露限(HBEL)时应考虑的要点》的定稿文件相关内容。今天我们来看看《GMP:制药用水》定稿...
|

|
WHO 新发布数据可靠性定稿指南,扩大适用范围
2021.03.31
世界卫生组织(WHO)于 3 月 29 日发布了第 55 届药物制剂规范专家委员会(ECSPP)技术报告 1033(TRS 1033),定稿了大批指南和标准,其中包括数据可靠性指南,对行业和检查人员都极为有价值。
此次定稿的数据可靠性指南旨在取代 WHO 于 2016 年 5 月发布的《数据与记录管理...
|

|
WHO 共线生产清洁验证残留限度定稿指南
2021.03.31
世界卫生组织(WHO)于 3 月 29 日发布了第 55 届药物制剂规范专家委员会(ECSPP)技术报告 1033(TRS 1033),其中定稿的指南之一是《清洁验证中包括基于健康的暴露限(HBEL)时应考虑的要点》。
WHO 表示,WHO 关于验证及其七个附录的更新始于 2013 年。ECSPP 现已修订...
|

|
加速批准艰难撤销:FDA否决荟萃分析结果,维持Makena...
2021.03.30
美国 FDA 上周发布通告表示,最近发表的一项关于 AMAG 公司早产预防药 Makena(己酸羟孕酮) 31 项随机对照试验的荟萃分析(meta-analysis)并不能改变 FDA 先前决定撤销加速批准并将产品从市场上撤出的决定。
FDA 对该荟萃分析的批评是 Makena 加速审批撤销漫漫长路中的最新...
|

|
北欧国家健康数据收集的经验教训:完整性、一致性、问...
2021.03.30
性能再好的汽车没有燃料/电就寸步难行。医疗卫生中的人工智能(AI)也是如此,即使拥有再出色的算法和技术,但没有燃料(数据)也寸步难行。而且不是任何燃料都可以,就像一些汽车在最高辛烷值汽油的情况下能够最好地运行一样,在干净和高质量的数据上 AI 也能最好地运行。
而访问此...
|

|
【一周回顾】2021.03.22-03.28
2021.03.29
国家局为贯彻《医疗器械监督管理条例》新发布与医疗器械生产、注册、经营以及体外诊断试剂注册管理办法修订草案征求意见稿。识林新增多个主题词,增加新储存容器(治疗用生物制品原料药)评价方法案例解析。FDA 发布 22 篇新 BE 指南,14 篇修订指南;重新修订非处方专论使用者付...
|

|
FDA 批准首个多发性骨髓瘤 CAR-T 疗法
2021.03.29
美国 FDA 于 3 月 26 日批准了首个针对晚期多发性骨髓瘤患者的个性化细胞疗法百时美施贵宝(BMS)公司的 Abecma。
FDA 批准 Abecma 用于治疗对至少四种不同类型的既往治疗方法没有应答或者治疗后复发的多发性骨髓瘤患者。BMS 和 Bluebird 表示治疗费用将为 419,500 美元。...
|

|
【周末杂谈】疫苗当先,众人挣钱
2021.03.28
卖新冠疫苗的企业当然赚钱,但供应链中的企业也是挣得盆盈钵满
本月初,美国政府宣布给默克公司2.7亿美元,帮助强生公司生产新冠疫苗。要知道,这是“出场费”,不是生产费,后者是单给的,一支疫苗给一支的钱。给出场费的借口是让默克改装生产设施,但众所周知,生产新冠疫苗是急活,连...
|

|
FDA 重新发布 2021 财年非处方药专论费率,场地费...
2021.03.27
美国 FDA 于 3 月 24 日重新公布了其新创立的非处方药(OTC)专论使用者付费法案(OMUFA)2021 财年的费率。
根据2020 年 3 月 27 日颁布的《冠状病毒援助、救助和经济安全法案》(CARES 法案),在《联邦食品、药品和化妆品法案》(FDCA)增加了新条款,该条款授权 FDA 评...
|

|
FDA 发布 36 篇 BE 指南,环索奈德和异丙托溴铵...
2021.03.26
美国 FDA 于 3 月 25 日发布了新一批 36 篇具体产品指南(PSG),为仿制药的开发以及生成支持简化新药申请(ANDA)批准所需的证据提供建议,从而有助于简化企业的仿制药开发和 FDA 的 ANDA 审评。
这是 FDA 2021 年发布的第一批 PSG 指南,一般 FDA 每年会有四次集中发...
|