
|
FDA 对于如何更好开展 OOS 调查的建议
2019.10.16
美国 FDA 持续在 483 和警告信中报告不良超标(OOS)调查,这是 FDA 目前急于解决的问题。FDA 药品审评与研究中心(CDER)合规办公室(OC)高级政策顾问 Brooke Higgins 在 9 月 17 日的 PDA/FDA 联席监管会议上表示,尽管 13 年前(2006 年)就已经发布处理 OOS 调查...
|

|
FDA 促进仿制药竞争政策的效果如何?言之过早
2019.10.15
10 月 11 日发表在美国医学会杂志(JAMA)Network Open 上的一篇文章指出,美国 FDA 增加简化新药申请(ANDA)审批的政策对于促进缺乏竞争和易发短缺领域的仿制药发展方面尚未产生明显效果。
FDA 自 2017 年以来采取了一系列行动,包括发布药品竞争行动计划,落实《FDA 重授...
|

|
FDA 关于雷尼替丁中 NDMA 杂质情况的问答
2019.10.14
继去年夏天在沙坦类降压药中检出含有致癌性的亚硝胺类杂质(包括 NDMA 等)之后,今年 9 月初,又在治疗胃灼热的雷尼替丁中发现同类杂质,受影响的产品中包含已广泛使用数十年的品牌药善胃得(Zantac)。事件仍不断发酵,各类报道的不断,令患者感到惶恐,对于监管机构的信心也有所动摇...
|

|
雷尼替丁中亚硝胺杂质问题的 FDA 进展梳理
2019.10.14
美国 FDA 于 10 月 11 日在网站上公布了关于雷尼替丁中 NDMA(N-亚硝基二甲胺)杂质的问答,以简短明了的语言回答了公众目前最为关心的问题,包括雷尼替丁是否都被召回了,为什么被召回,是否应停药,安全替代品有哪些等等。
雷尼替丁是一种 H2(组胺-2)阻滞剂,可减少胃产...
|

|
【更新提示】识林一周回顾(20191006-1012)
2019.10.13
【国务院】关于进一步做好短缺药品保供稳价工作的意见(10.11)
【国务院】印发关于进一步做好短缺药品保供稳价工作的意见(10.11)
在保供方面,一是加强协同监测。二是做好短缺药品清单管理。三是实施短缺药品停产报告。四是落实直接挂网和自主备案采购政策。五是建立健全短缺...
|

|
【周末杂谈】毒性杂质与仿制药企的可怜
2019.10.13
人们常说,新药的价格是由疗效决定的,且有堂堂药物经济学作证。但不知什么药物经济学支持新药每年涨价15%1,且连续多年(只要专利没过期)?要知道,虽然价格年年涨,但药可是从没有变过,而且总是称新药。也许有人会说,苹果手机价格也年年涨啊?但手机可是一年一个型号,功能逐年增加...
|

|
亚硝胺杂质事件引发监管部门思考质量范式转变
2019.10.12
接连在某些成熟的降压和抗酸药物中发现致癌性亚硝胺杂质意味着制药公司并不完全了解其产品。此类事件应引起监管机构的警觉,重新审视其老旧的质量评估模型,并转变药物杂质鉴定方法。这是 9 月 30 日至 10 月 2 日在爱尔兰都柏林举行的监管事务专家组织(Organisation for Professional...
|

|
2019 IPEM 年会(二轮通知)
2019.10.12
合理监管 Regulate Sensibly ,科学研发 Develop Scientifically ,高效生产 Manufacture Competitively ,尽责管理 Manage Responsibly
大家好,
与首轮通知相比,会议第二天上午提早半小时开始,下午取消了一次间歇,目的是增加报告和问答讨论时间。在拿到Marten Ritz和Bla...
|

|
FDA 三大中心主任讨论:药品批准标准是否过于宽松?
2019.10.11
从行业到学术界很多批评者都认为美国 FDA 的药品批准标准正在不适当地变低,并且所要求的批准后评估要么不充分,要么已被取消。但在 10 月 7 日在预见政策(Prevision Policy)和癌症研究之友(Friends of Cancer Research)主办的第五届生物制药大会上,三位 FDA 主任提出了反对...
|

|
ISPE 与 PDA 联合发布根本原因分析指南改善企业质...
2019.10.10
国际药物工程学会(ISPE)和非肠道药协会(PDA)于 10 月 7 日联合发布根本原因分析指南,以通过提供有关工具、技术和过程方面的建议来帮助制药业改善质量文化。
双方还于当天宣布签署了一项谅解备忘录(MOU),以交流有关各自在质量量度和质量文化方面工作的信息。根据 MOU,双方...
|

|
WHO 发布 2019 抗生素分类数据库加大力度应对耐药...
2019.10.09
世界卫生组织(WHO)于 10 月 1 日宣布已上线最新版本的 AWaRe 抗生素分类数据库,该数据库是一种管理工具,供各国政府在制定有关处方和监测抗生素政策时使用。
WHO 表示,该数据库不仅可以被政策制定者用来“支持制定绩效目标并指导各国对抗生素的最佳使用”,还可以被临床医生...
|

|
GDUFA 绩效报告显示仿制药审评时间有所改善
2019.10.08
美国 FDA 于 9月初发布了其递交给国会的 2018 财年仿制药使用者付费计划(GDUFA)绩效报告,报告中显示 GDUFA I 期(2013 财年-2017 财年)仿制药申请批准时间显著减少,反映了 FDA 和申办人在精简审批流程、完善申请资料方面的努力。
从 2013 财年到 2017 财年,ANDA...
|

|
PICS 拟拆分 GMP 附录 2 以包括先进治疗产品
2019.10.07
国际药品认证合作组织(PIC/S)提出拆分现有的 PIC/S GMP 指南附录 2,以解决与欧盟先进治疗医药产品(ATMP)GMP 指南的差异。PIC/S 正在邀请利益相关方就其将现有的 GMP 附录 2《人用生物原料药与制剂的生产》拆分为两个部分反馈意见。一部分将涵盖 ATMP(附录 2A),另一...
|

|
【周末杂谈】OTC助听产品的好日子来了?
2019.10.06
上年纪的人,听力削弱。听不清别人说话,听不清电视声音,容易让老人产生焦虑感和自卑感,加深孤独感,加速老年痴呆,降低平衡感,从而加速衰老过程。据世界卫生组织(WHO)2012年的研究报告,65岁以上老人中有近1/3因听力下降,严重影响健康。1
对于轻度到中度听力削弱的老人,采用体...
|

|
【更新提示】识林一周回顾(20190929-1005)
2019.10.06
【NMPA】国家药监局综合司公开征求《药品注册管理办法(修订草案征求意见稿)》《药品生产监督管理办法(修订草案征求意见稿)》《药品经营监督管理办法(征求意见稿)》意见(09.30)
【花脸稿】NMPA 药品生产监督管理办法(修订草案征求意见稿)(09.30)
在药品生产监督方面...
|
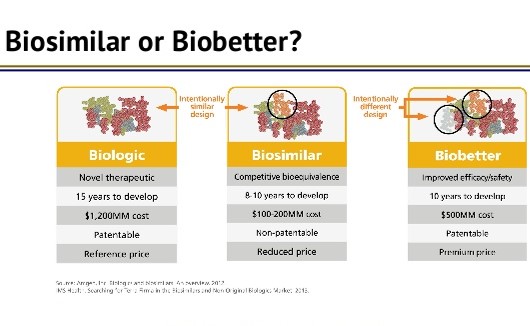
|
FDA 药品中心主任关注 biobetter,乐观看待生物类似...
2019.10.05
美国 FDA 药品审评与研究中心(CDER)主任 Janet Woodcock 于 9 月 23 日在药物信息协会(DIA)生物类似药会议上发表演讲,对美国生物类似药市场的未来表达了总体乐观的态度,但同时也惋惜地指出《生物制品价格竞争和创新法案》(BPCIA)缺乏“biobetter”路径。
Woodcock 表示,...
|

|
FDA 新检查方案项目扩展至非无菌药,使用质量成熟度...
2019.10.04
美国 FDA 宣布计划于明年将新检查方案项目(NIPP)扩展到非无菌药物,并简要介绍了 FDA 在检查过程中用于衡量药品质量的指标。
FDA 官员于 9 月 17-18 日在华盛顿举行的 PDA/FDA 联席监管会议上向业界简要介绍了 NIPP 项目,并表示,检查人员正在使用 St.Gallen 大学...
|

|
2018 财年 GDUFA 科学与研究成果
2019.10.04
Each year, FDA prepares annual reports on the science and research-funded projects conducted under the Generic Drug User Fee Amendments of 2017 (GDUFA II) regulatory science program. These reports provide greater transparency regarding the important w...
|

|
FDA 重要更新:ANDA 行动函转为仅电子邮件发送
2019.10.03
美国 FDA 于 10 月 1 日通过邮件通知表示,从本月起,拥有安全电子邮件账户的简化新药申请(ANDA)申请人将仅通过安全电子通讯收到行动函(包括:批准、暂时批准、完全回应函),因为 FDA,包括仿制药办公室(OGD)在内正在持续努力摆脱纸质通讯。
为帮助确保及时收到 FDA OGD...
|

|
FDA 质疑第三方实验室对雷尼替丁中致癌物的检测方法
2019.10.03
美国 FDA 于 10 月 2 日发布通告表示,在雷尼替丁中发现痕量致癌物的第三方实验室使用了一种“不适合”的检测方法,因此,FDA 认为该实验室得出的致癌物水平可能高于其它检测方法所得的结果。
FDA 虽然没有在通告中提及具体第三方实验室的名字,但在雷尼替丁中首先检出潜在致突...
|