|
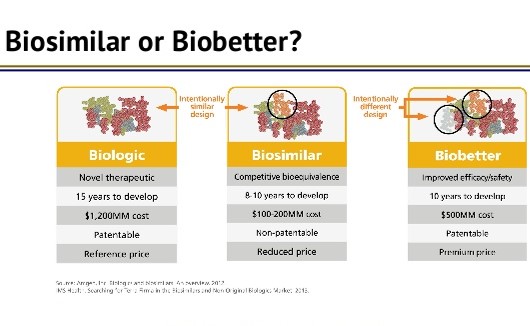
FDA 药品中心主任关注 biobetter,乐观看待生物类似...
2019.10.05
美国 FDA 药品审评与研究中心(CDER)主任 Janet Woodcock 于 9 月 23 日在药物信息协会(DIA)生物类似药会议上发表演讲,对美国生物类似药市场的未来表达了总体乐观的态度,但同时也惋惜地指出《生物制品价格竞争和创新法案》(BPCIA)缺乏“biobetter”路径。
Woodcock 表示,...
|

|
FDA 新检查方案项目扩展至非无菌药,使用质量成熟度...
2019.10.04
美国 FDA 宣布计划于明年将新检查方案项目(NIPP)扩展到非无菌药物,并简要介绍了 FDA 在检查过程中用于衡量药品质量的指标。
FDA 官员于 9 月 17-18 日在华盛顿举行的 PDA/FDA 联席监管会议上向业界简要介绍了 NIPP 项目,并表示,检查人员正在使用 St.Gallen 大学...
|

|
2018 财年 GDUFA 科学与研究成果
2019.10.04
Each year, FDA prepares annual reports on the science and research-funded projects conducted under the Generic Drug User Fee Amendments of 2017 (GDUFA II) regulatory science program. These reports provide greater transparency regarding the important w...
|

|
FDA 重要更新:ANDA 行动函转为仅电子邮件发送
2019.10.03
美国 FDA 于 10 月 1 日通过邮件通知表示,从本月起,拥有安全电子邮件账户的简化新药申请(ANDA)申请人将仅通过安全电子通讯收到行动函(包括:批准、暂时批准、完全回应函),因为 FDA,包括仿制药办公室(OGD)在内正在持续努力摆脱纸质通讯。
为帮助确保及时收到 FDA OGD...
|

|
FDA 质疑第三方实验室对雷尼替丁中致癌物的检测方法
2019.10.03
美国 FDA 于 10 月 2 日发布通告表示,在雷尼替丁中发现痕量致癌物的第三方实验室使用了一种“不适合”的检测方法,因此,FDA 认为该实验室得出的致癌物水平可能高于其它检测方法所得的结果。
FDA 虽然没有在通告中提及具体第三方实验室的名字,但在雷尼替丁中首先检出潜在致突...
|

|
FDA 再发警告信敦促再包装商披露原料药供应商
2019.10.02
美国 FDA 最近向重庆伊诺生化制品公司发出的警告信是 FDA 为保护美国患者免受药品供应链不透明带来的某些质量风险而采取的一系列行动中的最新动作。FDA 药品审评与研究中心(CDER)生产质量办公室(OMQ)主任 Francis Godwin 表示,这项工作正在使供应链更加透明,但仍需继续保持...
|

|
FDA 发布系列数字医疗指南澄清重点监管和放权领域
2019.10.01
美国 FDA 于9 月 26 日发布了一系列指南,旨在持续鼓励数字医疗工具的创新方法开发,并确保 FDA 监管这些技术的方法与时俱进。这些指南目的是在加速实验和对人工智能和数字医疗产品投资的同时,在确保安全和支持创新之间寻求微妙的平衡。
这些发布的指南是 FDA “数字医疗创新...
|

|
学习迎假期:BE缺陷案例等课程上线
2019.09.30
识林升级版用户可在PC端和App移动端学习包括覆盖药品研发、注册、生产、质量全生命周期28个模块的700+视频。包括IPEM项目部分精华课程摘要,监管和学术机构专题教学和研讨会,及供应商技术介绍专业课程。
除视频内生搜索,收藏,评论功能外,原声视频正在添加双语字幕,系列视频正在...
|

|
识林在线课程终于可以在App看啦
2019.09.30
在线课程今年在识林PC端上线以来,热心用户一直希望能在手机App移动学习,现终于成功上线,为丰富识林学友的假期和工作献上薄礼。除搜索,收藏,评论功能外,专业视频还具有双语字幕(部分),视频注释(部分),相关内容链接等具有识林特色的功能。视频特色功能介绍如下:
如何在App找...
|

|
【周末杂谈】假以时日,方能成正果?
2019.09.29
新药审批时,常有如下情况。美国FDA认为新药申请基本达到疗效和风险的接受标准。但出于对临床需求、风险确认和政策执行一致性等综合考虑,要求企业并得到企业的承诺,在药品上市后开展进一步的研究,为的是确认药品的疗效和风险,从而为FDA的进一步决策提供依据。这种要求和承诺就是所谓的...
|

|
【更新提示】识林一周回顾(20190922-0928)
2019.09.29
【CFDI】2018年度药品GMP跟踪检查报告(09.25)
2018年共开展药品GMP跟踪检查187家次,其中检查结论为不符合的18家,占10%,发告诫信的企业66家,占36%。检查不符合的主要问题包括:
1. 生产车间洁净区生产环境不符合要求,在厂房、设施、设备维护等方面存在严重问题。
2....
|

|
FDA 新药办公室改组方案获批,将于 2020 年初全面...
2019.09.28
美国 FDA 于 9 月 26 日宣布,国会已经批准了机构改组计划,该计划将把新药办公室(OND)转变为以疾病治疗领域为中心的结构。新组织架构预计将于 2020 年初全面实施。
OND 将把办公室数量从 6 个增加到 8 个,并将其临床部门从 19 个增加到 27 个。还将增加 6 个非...
|

|
FDA 向 IPEM 师生讲座
2019.09.28
9月24日,在FDA驻华办助理主任Lane Christensen和项目协调员王倩(她同时也是IPEM 2011级学员)的带领下,FDA一行与百余名IPEM师生在北京美丽的秋色中再次相聚。CDER合规办公室下属生产质量办公室(Office of Manufacturing Quality,OMQ)主任Francis Godwin先生,项目和监管运行...
|

|
FDA 与 IPEM 师生趣谈十年成就
2019.09.28
9月24日上午,FDA与IPEM师生和代表内部交流活动中,北京大学郑强教授代表师生抛出的最后一问:FDA合规监管过去十年最大成就是什么? CDER药品质量办公室下属警戒办公室质量情报、风险分析和建模处主任 Jennifer Maguire打趣说:“最大的成就是雇佣了我”,引起了一番趣谈。
(一...
|

|
不再透明?FDA不顾反对力求减少审评报告公开信息
2019.09.27
美国 FDA 新药办公室(OND)主任 Peter Stein 在 9 月 24 日下午的 RAPS 监管趋同闭幕会上, 向与会人员确认,申办人和其他感兴趣的利益相关方如果希望检索一些当前在 FDA 发布的药品批准文件包中可获得的数据,在新的综合审评(integrated review)计划下将需要通过信息自由法...
|

|
FDA 公布诺华对数据操纵问题的 483 回复
2019.09.26
美国 FDA 于 9 月 24 日公布了 诺华公司在 8 月 23 日提交给 FDA 的有关其基因治疗药数据操纵问题的 483 回复。这份长达 59 页的回复函中指出,由于调查的“高度复杂”性而未能尽快将这一问题告知 FDA,并将问题责任归咎于两名 AveXis 高管。
诺华下属子公司 AveXis 公司...
|
|
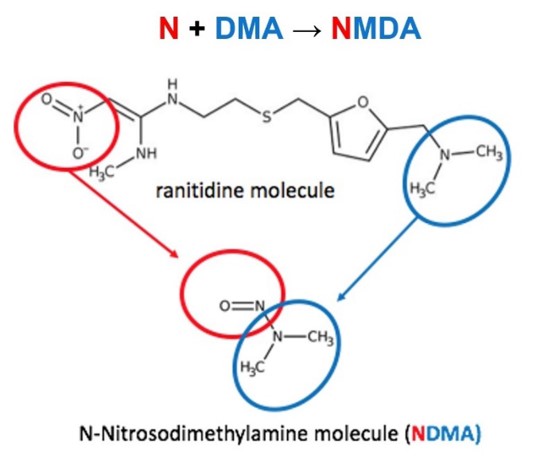
雷尼替丁因含 NDMA 在多国被禁,不只是杂质污染那么...
2019.09.25
到目前为止,世界范围内有十几个国家正在采取行动,限制或禁止销售含有潜在致突变杂质 N-亚硝基二甲胺(NDMA)的雷尼替丁,包括赛诺菲公司生产的品牌药 Zantac(善胃得)。有机构提出,由于其不稳定性,雷尼替丁药物本身或成为一种潜在致癌物。
NDMA 等亚硝胺类杂质因去年夏天在沙...
|

|
FDA 总结 2019 财年警告信四大趋势
2019.09.24
美国 FDA 生产质量办公室副主任 Rick Friedman 于 9 月 16 日在华盛顿举行的 PDA/FDA 联席监管会议上,对 2019 财年最新 GMP 违规导致的警告信发布情况做了通报,并通过最近一些警告信来举例说明了检查员发现的一些缺陷项。
本财年到目前为止生产质量办公室已发布 89 封...
|

|
FDA 两大中心主任讨论如何克服生物制造创新障碍
2019.09.23
美国 FDA 生物制品中心(CBER)主任 Peter Marks 和药品中心(CDER)主任 Janet Woodcock 在今年 6 月下旬国家生物制药制造创新研究所(NIIMBL)第三次年会上分别做了报告,讨论了制药业制造创新方面的现状与面临的挑战以及如何克服障碍。
Marks 提出,公私合作在推进细胞和基因治疗...
|

|
【周末杂谈】为信息技术鸣冤
2019.09.22
“新上的信息系统太差了,老出错”,“这个软件太笨了,还不如我手工做”。这样的话可能大家常听到。
多年前,在我开始学计算机编程时,导师对我说“没有笨的计算机程序,只有笨的编程人员”。道理简单,信息系统是按程序员事先设计编写好的程序行事。它不会犯错,因为它只是忠实地执行...
|