
|
微生物治疗药物:制造方面的挑战
2019.06.07
随着对专门选择或设计用于治疗疾病的细菌越来越多的关注和希望寄托,开发这类微生物药物的公司可能会遇到有可能花费数百万美元或减缓其进展的障碍。障碍是什么?微生物药物的制造问题。
微生物药物是指利用正常微生物或调节微生物正常生长的物质研制而成的药物制剂,包括粪便菌群、活体...
|

|
重新设计面向21世纪的质量部门
2019.06.06
前两天的文章介绍了有关质量的思维方式的改变,包括如何重新定义质量,质量部门应该停止做的10件事,以及如何更好地吸引利益攸关者,质量如何为公司增值。通过今天的文章,我们来看看这支首席质量官团队将如何重新设计质量部门,未来的质量专业人才应包括哪些技能组合以及团队的未来研究...
|

|
摒弃无稽之谈 — 讨论和思考质量的更好方式
2019.06.05
本篇文章重点是努力解决质量部门中似乎存在的系统性问题,所涉信息来自于一个由多家制药、器械、动物健康和消费品跨国公司的首席质量官(CQO)团队。昨天的文章【质量部门应该立刻停止做的 10 件事】重点关注为何在公司中质量部门被认为是消极的,缺乏对质量的共同定义,以及质量部门...
|

|
质量部门应该立刻停止做的 10 件事
2019.06.04
【编者按】质量一直是制药行业的关注重点,关于药品质量、质量保障、质量文化的思考和研究从未停止过。监管者和行业都认为现在到了改变质量部门运作方式的时候了。接下来几天我们将报道 FDA/Xavier PharmaLink 会议上关于质量前沿的讨论。
高层质量领导者和FDA承认,支持药品生...
|

|
【更新提示】识林一周回顾(20190526-0601)
2019.06.02
【IPEM】6月课程通知 厂房设施设计与口服固体制剂开发(05.29)
IPEM 6月份厂房设施设计与口服固体制剂开发课程即将在北京开班,课程安排如下:
6月18日-19日,杨军高级工程师将对厂房设施设计如何符合药品GMP要求、如何编写URS进行全面讲解,并重点以口服固体制剂与无菌注射剂车...
|

|
设备没清洗?工人欢度假期去了
2019.06.01
警告信是掌握美国FDA的CGMP合规要求和趋势的重要学习资料,不仅包含制药企业不该触碰的合规“红线”,还警示企业遇到问题不该采用的错误解决思路。但今天我们选出的这封警告信却有着搏君一笑的作用,其中的缺陷项并不独特,但是企业的解释却令人称奇。
这是一封美国 FDA 于 5 月 2...
|

|
FDA 将于今年发布或修订的法规一览
2019.05.31
美国联邦政府每年两次发布https//www.reginfo.gov/public/do/eAgendaMain 《联邦监管和去监管化行动统一议程》,为美国公众提供对整个联邦政府正在制定或审查的法规的深入了解。2019 年春季的统一议程中关于美国 FDA 的部分,概述了 FDA 在 2019 年“希望”或“考虑”发布...
|
|
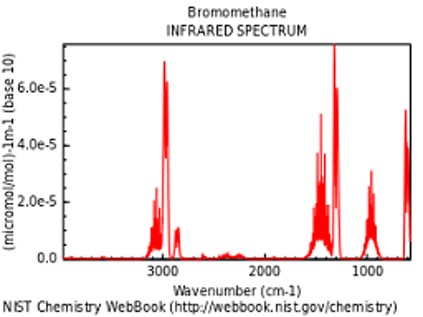
简谈新版 USP 光谱鉴别要求变化带来的问题
2019.05.30
新版《美国药典-国家处方集》(USP 42 -NF 37)于今年 4 月 30 日生效之前,USP 章《光谱鉴别检测》规定,“物质的红外(IR)吸收光谱与相应 USP 参照标准品相比,提供可能是任何单一检测中实现物质鉴别的最为确凿的证据。”该章节表示可以对样品和标准品同时分析,并通过比较...
|

|
WHO 检查机构质量体系要求指南重要更新
2019.05.29
世界卫生组织(WHO)于 5 月 23 日发布《国家检查机构的质量体系要求》工作文件征求意见稿,对已经实施了 17 年的适用于国家 GMP 检查机构的基本质量体系要求进行了重大修订。WHO 建议扩大指南涵盖范围,并使其内容与国家标准和最新的质量管理体系(QMS)原则保持一致。修订后的...
|

|
ICH 将于近期发布和起草的指南一览
2019.05.28
美国 FDA 于 4 月 29 日上午与加拿大卫生部联合举办了 ICH 公开咨询会议,简要介绍了十几份不同 ICH 指南的进展和可能的预期。
在这个持续三小时的会议上,三位 FDA 专家和北卡罗来纳大学生物统计学教授 Lisa LaVange 讨论了近期进入 ICH 流程第 3 阶段的指南主题。F...
|

|
WHO 强化 GMP 在预防抗微生物药耐药性方面的作用
2019.05.27
世界卫生组织(WHO)于 5 月 15 日发布了一份《GMP 环境方面 — 生产商和检查员在预防抗微生物药耐药性方面需要考虑的要点》的工作文件草案。
WHO 解释指出,抗微生物药耐药性(antimicrobial resistance,AMR)是比抗生素耐药性更广泛的术语,因为 AMR 包括对治疗更多微生...
|

|
【更新提示】识林一周回顾(20190519-0525)
2019.05.26
【NMPA】关于印发《国家药品监督管理局关于加快推进药品智慧监管的行动计划》的通知(05.25)
为加快推进药品智慧监管,构建监管“大系统、大平台、大数据”,实现监管工作与云计算、大数据、“互联网+”等信息技术的融合发展,创新监管方式,服务改革发展,制定如下国家药品监督管理...
|

|
质量文化日益受到监管者和企业关注
2019.05.25
前日,美国 FDA 副局长 Mark Abdoo(杨渡)先生在北京大学以质量文化为题做了报告,强调了质量、诚信和创新三个做人和制药的重要概念。【质量、诚信与创新 – FDA副局长在北大演讲】。业界对质量文化的关注日益增加,监管机构和行业专家都强调,仅靠法规和指南中规定的技术控制和说...
|

|
质量、诚信与创新 – FDA副局长在北大演讲
2019.05.24
2019年5月23日上午,美国FDA副局长Mark Abdoo杨渡先生一行与国际药物工程管理 (International Pharmaceutical Engineering Management, IPEM)和北大师生见面会在北京大学医学部举行。
自2006年支持IPEM项目创办以来,美国FDA已经派出百余人次授课,局长级别的访问交流虽然也已...
|
|
FDA 发布生物类似药比对分析及其它质量考虑指南草案
2019.05.23
美国 FDA 于 5 月 21 日发布《治疗性蛋白质生物类似药的开发:比对分析评价和其它质量考量》指南草案。指南介绍了 FDA 对于支持生物类似性证明的比对分析研究的设计和评价的建议,包括开发使用逐步方法的比对分析评价计划的考量。指南还向申办人提供了有关拟议生物类似药产品上市...
|

|
FDA 实时肿瘤学审评试点一览
2019.05.22
5 月 15 日,美国 FDA 批准 Venclexta(venetoclax 片剂)用于患有慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)的成年患者。FDA 对该申请使用了实时肿瘤学审评(Real-Time Oncology Review,RTOR)和评估协助(Assessment Aid)试点项目,并授予了优先审评以及孤儿药...
|

|
FDA 2019 首仿批准清单更新
2019.05.21
美国 FDA 于 5 月 17 日更新了其首仿药批准清单,这是其今年第二次更新,本年度第一次更新在 3 月 8日 【FDA 发布今年第一批首仿批准清单】。根据这份清单,到 4 月 26 日为止,FDA 仿制药办公室(OGD)共批准了 43 个首仿药。
FDA 指出,“首仿药”的定义正如其名,是...
|

|
真实世界证据支持申请批准的时代已经到来?
2019.05.20
美国 FDA 于 5 月 8 日发布指南草案《向 FDA 提交使用真实世界数据和真实世界证据的药品和生物制品文件》,表示将跟踪在研究用新药申请(IND)、新药申请(NDA)或生物制品许可申请(BLA)下或在批准后提交的真实世界证据(RWE)申报材料,希望申办人使用简单、统一的格式来识别真...
|

|
【更新提示】识林一周回顾(20190512-0518)
2019.05.19
【IPEM】5月课程通知 药品全生命周期的质量管理&质量体系与风险管理(05.12)
5月份质量管理体系专题课即将在上海开班,课程安排如下:
5月23-24日,由周康平博士和罗瑞昌博士主讲药品全生命周期的质量管理(ICH Q10)。全面系统地讲解ICH Q10“制药质量体系”指南,阐释制药企...
|

|
FDA 新全球办公室将在决定贸易政策方面发挥更大作用
2019.05.18
美国 FDA 新的全球政策和战略办公室(OGPS)正在将 FDA 的业务范围扩展到传统上不属于其管辖的领域(例如,贸易),同时增强美国对全球公共卫生威胁的应对,并提升与其他监管机构之间互认协议的重要性。
FDA 新的政策、立法和国际事务办公室(OPLIA)副局长 Anna Abram 于 5 ...
|