
|
FDA 与 IPEM 师生趣谈十年成就
2019.09.28
9月24日上午,FDA与IPEM师生和代表内部交流活动中,北京大学郑强教授代表师生抛出的最后一问:FDA合规监管过去十年最大成就是什么? CDER药品质量办公室下属警戒办公室质量情报、风险分析和建模处主任 Jennifer Maguire打趣说:“最大的成就是雇佣了我”,引起了一番趣谈。
(一...
|
|
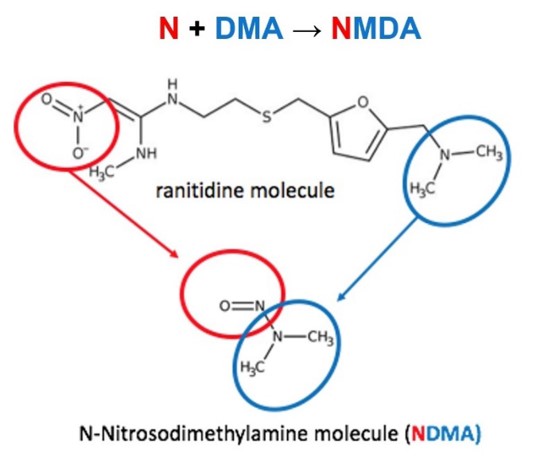
雷尼替丁因含 NDMA 在多国被禁,不只是杂质污染那么...
2019.09.25
到目前为止,世界范围内有十几个国家正在采取行动,限制或禁止销售含有潜在致突变杂质 N-亚硝基二甲胺(NDMA)的雷尼替丁,包括赛诺菲公司生产的品牌药 Zantac(善胃得)。有机构提出,由于其不稳定性,雷尼替丁药物本身或成为一种潜在致癌物。
NDMA 等亚硝胺类杂质因去年夏天在沙...
|

|
FDA 总结 2019 财年警告信四大趋势
2019.09.24
美国 FDA 生产质量办公室副主任 Rick Friedman 于 9 月 16 日在华盛顿举行的 PDA/FDA 联席监管会议上,对 2019 财年最新 GMP 违规导致的警告信发布情况做了通报,并通过最近一些警告信来举例说明了检查员发现的一些缺陷项。
本财年到目前为止生产质量办公室已发布 89 封...
|

|
FDA 两大中心主任讨论如何克服生物制造创新障碍
2019.09.23
美国 FDA 生物制品中心(CBER)主任 Peter Marks 和药品中心(CDER)主任 Janet Woodcock 在今年 6 月下旬国家生物制药制造创新研究所(NIIMBL)第三次年会上分别做了报告,讨论了制药业制造创新方面的现状与面临的挑战以及如何克服障碍。
Marks 提出,公私合作在推进细胞和基因治疗...
|
|
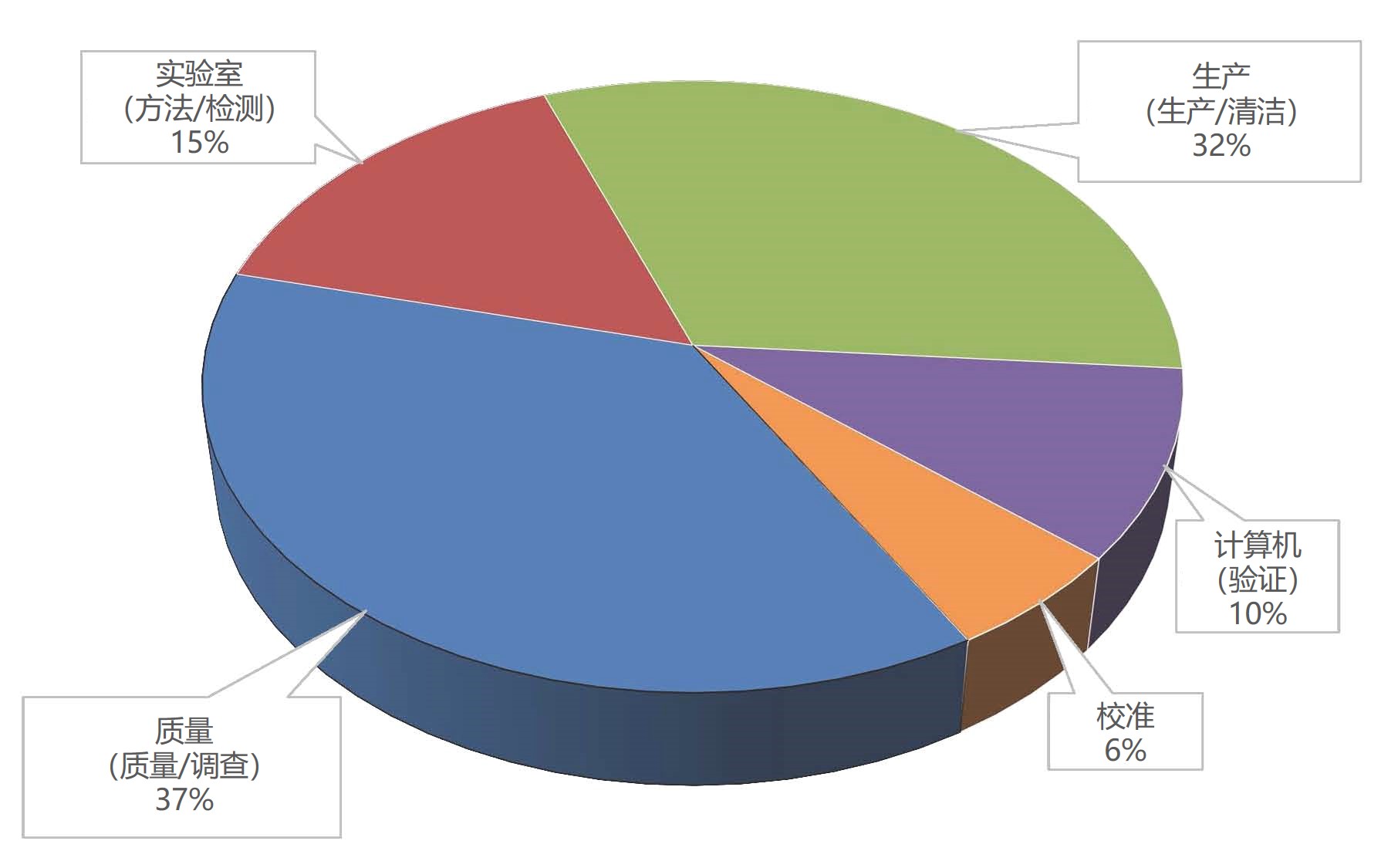
FDA点评2018财年十大引证项,数据可靠性和质量文化仍...
2019.09.20
美国 FDA 监督消费者安全办公室的官员 Dell Moller在今年三月份的 FDA/Xavier PharmaLink 会议上报告了 FDA 2018 财年十大最常见药品 GMP 检查引证项。本文总结了 Moller 幻灯片中 FDA 对各引证项的简要分析,以及 Moller 与 FDA 专家组成员 FDA 药品质量运营办公室(OPQO)3...
|

|
制药业公众形象垫底,医疗卫生业倒数第三
2019.09.14
制药业现在是美国公众眼中最不受欢迎的行业,根据盖洛普(Gallup)民意调查,制药业在其每年调查的 25 个行业中排名垫底。比起三年前倒数第二的排名,制药业的不受民众欢迎程度再创新低。【民众为何对制药业的好感每况愈下? 2016/09/14】美国民众对于制药业给出负面评价的比例达 58...
|

|
FDA 新版批准前检查手册精华导读 II:数据可靠性的...
2019.09.10
上周五识林资讯中介绍了FDA 8月13日发布的新版批准前检查手册的第一部分导读,关于三大检查目标的第一个:商业化生产是否准备就绪,另外两个目标是与申报资料的一致性和数据可靠性,这两条本质都是监管机构与企业建立信任的依据,区别是申报资料一致性强调申报资料本身的可信程度,关注...
|

|
FDA新版批准前检查手册精华导读 I:商业化生产准备就...
2019.09.06
2019年8月13日,FDA发布了新版《批准前检查手册》(CPGM 7346.832 Pre-Approval Inspections-Investigations),合规项目指南手册(Compliance Program Guidance Manual,CPGM)为 FDA 人员评价企业合规性活动时提供指导,是FDA指导检查员的工作手册,其中包含了对FDA检查员...
|

|
2019 IPEM年会
2019.09.05
合理监管 Regulate Sensibly ,科学研发 Develop Scientifically ,高效生产 Manufacture Competitively ,尽责管理 Manage Responsibly
2019 IPEM年会
北京大学中关新园1号楼 科学报告厅 2019年10月17-18日(周四-周五)
鸣谢:IPEM顾孝诚基金,IPEM 课...
|

|
从警告信看 FDA 对 OTC 生产商的四个关注重点
2019.09.05
美国 FDA 最近向非处方药(OTC)和保健产品生产商发出的一连串警告信显示了与 GMP 和质量管理监管期望相关的相似缺陷。
这些警告信中反复出现的许多基本问题表明了质量管理体系(QMS)的潜在不足之处。其中包括由于管理不善以及缺乏合适的经验证的检测所导致的微生物污染,生产操作...
|

|
FDA 境外检查数量增加,执法行动比率更高
2019.09.03
昨天我们介绍了“海边 GMP”年会上美国 FDA 对于拥有成熟质量体系的重视【FDA 关于质量体系成熟度十大标志的建议 2019/09/02】,今天我们结合 FDA 发布的检查信息来看看此次会议上报告的 FDA 合规检查情况和一些统计数据。
药品方面
FDA 统计数据显示,尽管 FDA 药品审评...
|

|
连续制造深陷泥潭,如何改变现状?
2019.08.27
连续制造一直以来是讨论热点,监管机构大力提倡,企业存有顾虑,技术、成本和监管批准上都面临着种种挑战。8 月 2 日在线发表在《药物科学杂志》(Journal of Pharmaceutical Sciences)上的一篇文章“连续制造的动因及如何实现:国际连续制造学术研讨会综述”(Why We Need Continuous...
|

|
新修订药品管理法表决通过,附答记者问摘录
2019.08.26
摘要:
1. 对药品管理法的全面修改体现了“四个最新”。
2. 鼓励药物创新方面的举措。
3. 上市许可持有人制度。
4. 儿童用药。
5. 药品追溯制度。
6. 未经批准进口的药品,网上售药。
7. 最严厉处罚。
8. 与疫苗法的衔接。
今日上午(2019 ...
|

|
FDA 公告对一家药商伪造文件的惩处
2019.08.22
美国 FDA 于 8 月 20 日在其新闻公告中表示向一家中国非处方药(OTC)制药商发出了一封警告信,内容涉及包括数据可靠性在内的 CGMP 违规行为。这是 FDA 不太常见地通过新闻公告和邮件订阅的形式公布其向某家公司发出警告信,宣传力度之大或许与公司所生产的产品性质有关,FDA ...
|

|
缬沙坦危机新进展:FDA 瞄准回收溶剂供应商
2019.08.20
美国 FDA 在沙坦类降压药含有潜在致癌物事件之后审查了几乎所有制药商,现在他们有了新目标。通过将目光瞄向溶剂回收商,FDA 表明了其打算将沙坦类产品致癌杂质的调查和药品 GMP 要求的执行范围扩展到所涉及的原料药和成品制剂之外的意图。
FDA 官员此前曾警告制药商不要使用重复...
|

|
FDA 境外飞行检查摆上桌面,直指中国和印度
2019.08.17
美国参议院财政委员会主席共和党议员 Chuck Grassley 于 8 月 6 日在写给美国卫生部部长和 FDA 代理局长的一封信中表示,希望对于国外制药工厂,尤其是中国的工厂,FDA 不再提前通知检查安排而是开展不经提前通知的“飞行检查”。
Grassley 在信中写道,美国药品中使用的原料...
|

|
FDA 向国外发出的警告信四分之三涉数据可靠性
2019.08.13
昨天的资讯介绍了企业如何换个角度从监管视角审查自身问题,在监管检查之前发现隐藏的数据可靠性缺陷。今天我们从一些警告信观察项数据以及资深专业人士的建议来继续看看如何及早、高效的发现数据可靠性问题。
前 FDA 检查员、Parexel 咨询公司副总裁 Ron Tetzlaff 于 2019 年...
|

|
企业应从监管视角审查自身数据可靠性
2019.08.12
数据可靠性(data integrity, DI)监管合规专家观察到,行业内部和第三方审计人员通常不会发现数据可靠性失败,因为他们没有像 FDA 检查员那样查看系统和流程。即使在公司已经针对即将到来的检查执行了多次审计的情况下,监管机构也能识别出公司尚未发现或者尚未进行风险评估的 DI ...
|

|
从教训开始学习 – 看看回复483有哪些常犯的错
2019.08.06
是不是检查结果不好就会收到警告信呢?根据识林483数据库(即将上线,数据库收录了美国FDA 过去十年近50000条检查信息和6000多封483报告原文,还可提供检查员信息等迎检定制服务),官方行动指示(OAI)最终转化为警告信的比例近似为20%(考虑到检查结果的升级和降级,这个比例是假设FDA...
|
|
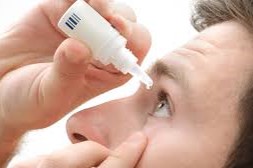
患者收到的一封药品召回信
2019.08.05
这是我在美国首次收到一封来自经销商(不是生产商)的药品召回电子信,其中明确说明了召回原因,召回药品对患者的安全影响,给患者的补救方式,以及具体的召回批次等。邮件为患者着想,简明扼要。特与大家分享。
Dear Patients,
亲爱的患者:
Natural Ophthalmics Eye Drops ha...
|