
|
创新药 MAH 早期临床阶段需要什么程度的质量体系?
2020.01.10
MAH推进和创新药热潮,催生生产和检验完全外包的虚体药企。那么问题来了,这些企业在早期临床,具体来说就是临床I期,需要什么程度的质量体系呢?具体而言,需要多少个SOP呢?尤其是全生命周期GMP管理理念的盛行,可能产生两极分化,造成资源浪费和效率低下,甚至本末倒置 – 临床I期的...
|

|
【周末杂谈】从FDA警告信看GMP“软件”部分的重要性
2020.01.05
上周的周末杂谈“判断是否低于成本竞标,不容易”,谈到与药品生产相关的“硬件”成本,包括:设施、设备、物料、能耗、人工及管理费用方便计算;“软件”成本,例如:处方工艺研发、GMP管理和合规运行的费用难于计算。今天的杂谈想说这个“软件”部分,尽管成本难以计算,其重要性不可低...
|

|
国际检查互认不断拓展,菲律宾加入东盟互认协议
2020.01.02
国际检查合作和互认已是大势所趋,下一步的工作是在深度和广度上的进一步扩展。过去识林多次报道了美国、欧盟、加拿大、英国、澳大利亚、日本之间的合作和互认,今天识林带你来看看我们的邻居 — 东盟,在检查互认方面的工作。
在经过一长段时间包括文件、现场、过程中检查评估的审...
|

|
FDA 副局长谈美欧药品检查互认协议的影响
2020.01.02
美国 FDA 全球政策与战略副局长 Mark Abdoo 最近在 FDA 《全球视角》栏目中谈到了自美国/欧盟互认协议(MRA)实施以来一些影响性数据,并承认 MRA 还需要收集更多数据,纳入更多衡量指标,从而帮助 FDA 分配资源并扩展 MRA 的范围和广度。
当我们首次开始与欧盟讨论互...
|

|
欧盟拟加强原料药安全性监督,重点关注中国和印度
2019.12.26
上周我们刚刚在【无菌药品检查国际合作试点启动,中国和印度或将面临更严检查】中预测了检查国际合作可能会让参与国家将更多检查资源集中在中国和印度,现在欧盟的另一份文件就挑明了这一问题。欧盟委员会认为最近涉及到从中国和印度进口的原料药(API)污染问题(缬沙坦和雷尼替丁中的亚...
|
|
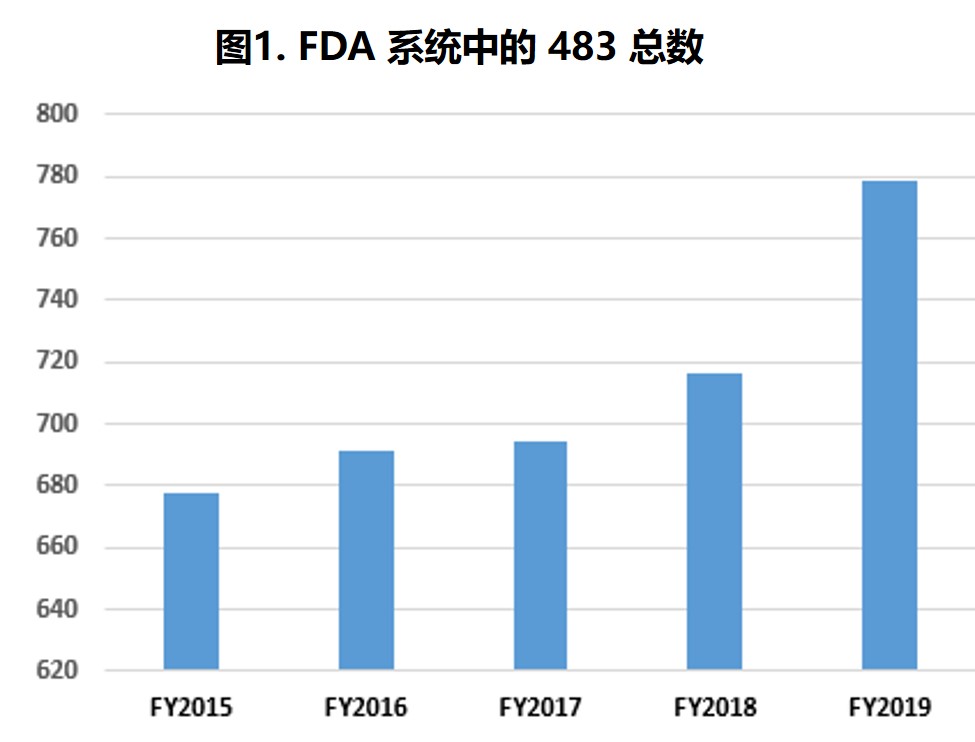
FDA 2019 财年药品检查观察项和趋势
2019.12.19
过去五个财年中,分析中所包含的 483 数量每年都略有增加,检查次数在 645 到 779 次之间(表1第2行和图1)。
自 2013 财年以来,指证 §211.192(偏差调查)失败的观察项在 2018 财年首次从名单魁首的位置上移下来。
2018 财年,§211.160(b)(实验室控制应包括科学合...
|

|
无菌药品检查国际合作试点启动,中国和印度或将面临更...
2019.12.19
欧洲药品管理局(EMA)于 12 月 17 日宣布启动一项为期两年的无菌药品 GMP 检查国际合作试点计划,该计划可以使包括欧盟、美国、英国、澳大利亚、加拿大、日本等国在内的监管机构共享无菌药品生产场地的 GMP 检查信息。参与机构由此而节约的检查资源或将更多的集中在高风险场地和...
|

|
两家美国公司因 GMP 违规收到 FDA 警告信
2019.12.12
美国 FDA 于 12 月 10 日因 GMP 违规向两家美国制药商发出警告信,这两家公司分别为位于新泽西州 Buena 市的 Teligent 药业和位于德克萨斯州 Mineral Wells 市的 OHM 药业公司。警告信原文及翻译请登录识林阅览。
Teligent Pharma
FDA 于今年 4 月到 5 月期间对 T...
|

|
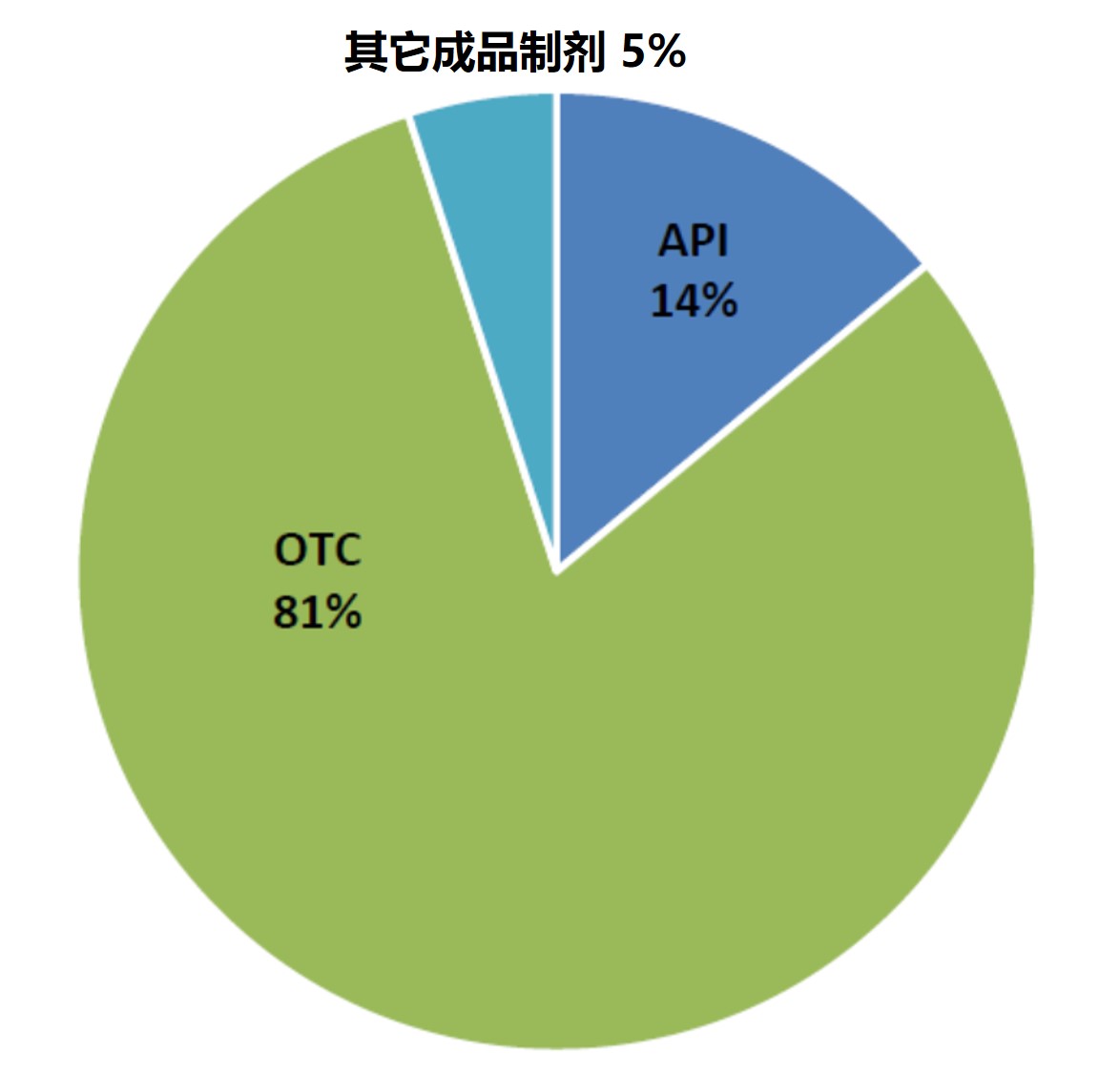
美国 FDA 向印度制药与器械企业发布的警告信分析
2019.11.21
在过去 14 年内,FDA 向印度制药和器械企业发出的警告信数量逐渐增多。在警告信列出的所有违规行为中,85.87% 与 CGMP 不合规有关。此外,在这些警告信中有 80.72% 在之后没有关闭函。
这一回顾性研究于 11 月 5 日发布于 DIA 《治疗创新与监管科学杂志》上,分析回顾了 20...
|
|
FDA 从未检查过的生产场地中四分之一 GMP 不合规
2019.11.08
我们在昨天的资讯中介绍了从 2015 财年到 2019 财年,FDA 发出的与生产质量相关的警告信数量激增,从 2015 财年的 19封到 2019 财年的98 封,昨日我们介绍了这些警告信的去向以及警告信周转时间缩短【FDA 警告信数量增加时间缩短,原料药商应注意三大趋势】。今天我们来看看导...
|

|
临床早期药品生产的 GMP 合规是避免申请被拒的关键
2019.10.22
为避免日益增加的与 GMP 相关的新药批准延迟,企业应更早开始遵守美国 GMP 要求,Covington Burling 律所合伙人 Tom Cosgrove 在 9 月 19 日的 PDA 数据可靠性研讨会上如是表示。他指出,企业应在就 I 期临床研究递交研究用新药申请时就开始遵守 GMP,但目前大多数企业等到...
|

|
PICS 拟拆分 GMP 附录 2 以包括先进治疗产品
2019.10.07
国际药品认证合作组织(PIC/S)提出拆分现有的 PIC/S GMP 指南附录 2,以解决与欧盟先进治疗医药产品(ATMP)GMP 指南的差异。PIC/S 正在邀请利益相关方就其将现有的 GMP 附录 2《人用生物原料药与制剂的生产》拆分为两个部分反馈意见。一部分将涵盖 ATMP(附录 2A),另一...
|

|
FDA 向 IPEM 师生讲座
2019.09.28
9月24日,在FDA驻华办助理主任Lane Christensen和项目协调员王倩(她同时也是IPEM 2011级学员)的带领下,FDA一行与百余名IPEM师生在北京美丽的秋色中再次相聚。CDER合规办公室下属生产质量办公室(Office of Manufacturing Quality,OMQ)主任Francis Godwin先生,项目和监管运行...
|

|
FDA 总结 2019 财年警告信四大趋势
2019.09.24
美国 FDA 生产质量办公室副主任 Rick Friedman 于 9 月 16 日在华盛顿举行的 PDA/FDA 联席监管会议上,对 2019 财年最新 GMP 违规导致的警告信发布情况做了通报,并通过最近一些警告信来举例说明了检查员发现的一些缺陷项。
本财年到目前为止生产质量办公室已发布 89 封...
|
|
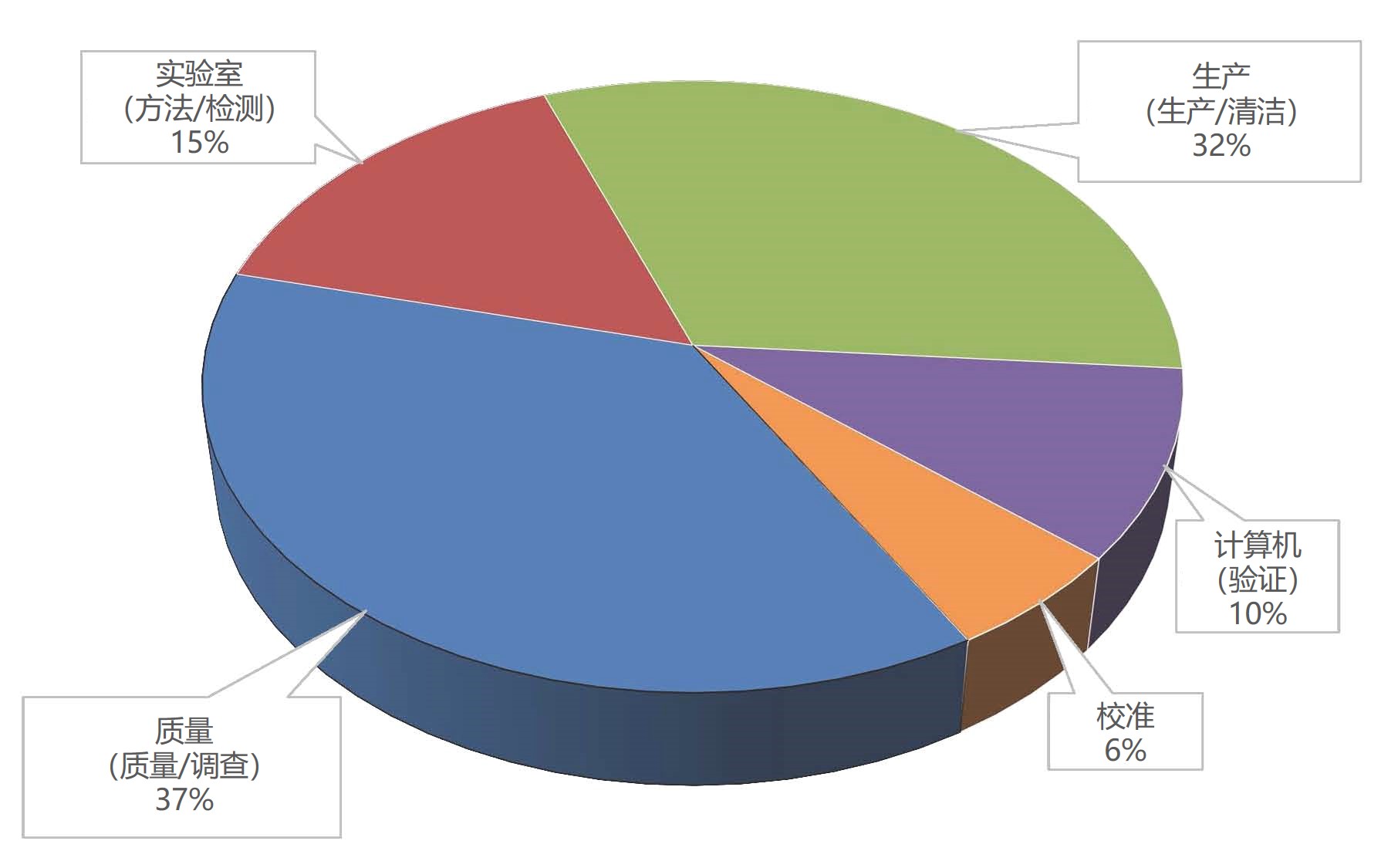
FDA点评2018财年十大引证项,数据可靠性和质量文化仍...
2019.09.20
美国 FDA 监督消费者安全办公室的官员 Dell Moller在今年三月份的 FDA/Xavier PharmaLink 会议上报告了 FDA 2018 财年十大最常见药品 GMP 检查引证项。本文总结了 Moller 幻灯片中 FDA 对各引证项的简要分析,以及 Moller 与 FDA 专家组成员 FDA 药品质量运营办公室(OPQO)3...
|

|
FDA 新版批准前检查手册精华导读 II:数据可靠性的...
2019.09.10
上周五识林资讯中介绍了FDA 8月13日发布的新版批准前检查手册的第一部分导读,关于三大检查目标的第一个:商业化生产是否准备就绪,另外两个目标是与申报资料的一致性和数据可靠性,这两条本质都是监管机构与企业建立信任的依据,区别是申报资料一致性强调申报资料本身的可信程度,关注...
|

|
FDA新版批准前检查手册精华导读 I:商业化生产准备就...
2019.09.06
2019年8月13日,FDA发布了新版《批准前检查手册》(CPGM 7346.832 Pre-Approval Inspections-Investigations),合规项目指南手册(Compliance Program Guidance Manual,CPGM)为 FDA 人员评价企业合规性活动时提供指导,是FDA指导检查员的工作手册,其中包含了对FDA检查员...
|

|
从警告信看 FDA 对 OTC 生产商的四个关注重点
2019.09.05
美国 FDA 最近向非处方药(OTC)和保健产品生产商发出的一连串警告信显示了与 GMP 和质量管理监管期望相关的相似缺陷。
这些警告信中反复出现的许多基本问题表明了质量管理体系(QMS)的潜在不足之处。其中包括由于管理不善以及缺乏合适的经验证的检测所导致的微生物污染,生产操作...
|

|
FDA 境外检查数量增加,执法行动比率更高
2019.09.03
昨天我们介绍了“海边 GMP”年会上美国 FDA 对于拥有成熟质量体系的重视【FDA 关于质量体系成熟度十大标志的建议 2019/09/02】,今天我们结合 FDA 发布的检查信息来看看此次会议上报告的 FDA 合规检查情况和一些统计数据。
药品方面
FDA 统计数据显示,尽管 FDA 药品审评...
|
|
FDA 关于质量体系成熟度十大标志的建议
2019.09.02
8 月 12 -14 日在美国马里兰州 Cambridge 举行的“海边 GMP”年会上,美国 FDA 的合规部门鼓励制药公司确保他们展示“质量成熟度”,并提供有关 FDA 希望看到的具体内容。FDA 对于成熟质量体系的建议既适用于初创公司也适用于老牌制药商和申办人,既适用于制药企业也适用于医...
|