
|
新冠疫苗加速生产下 CMO 面临的挑战
2020.12.26
产能限制、规模放大挑战以及人才缺乏是合同制造组织(CMO)在生产用于新冠(COVID-19)疫苗的物料时所面临的一些障碍。
在 12 月 1 日举行的生命科学专家小组讨论会上,赛默飞世尔(Thermo Fisher)和 BioPlan 的专家小组成员指出,最近对 mRNA 疫苗的紧急使用授权,对克服上...
|

|
英国和印度或于下周批准阿斯利康新冠疫苗
2020.12.24
印度很可能在下周批准牛津/阿斯利康的新冠(COVID-19)疫苗用于紧急使用,可能成为第一个为阿斯利康疫苗提供监管许可的国家。而英国紧急情况科学顾问小组成员本周三也表示英国政府可能会在圣诞节之后授权阿斯利康疫苗。
据路透社报道,印度作为世界上最大的疫苗生产国,希望在下个月...
|
|
FDA 发布疫情期间审评时限指南,试图降低申请人期望...
2020.12.23
美国 FDA 于 12 月 21 日发布《COVID-19 公共卫生紧急事件期间申请人对完全回应函的回复需要设施评估时的审评时限》立即生效指南,解释了 FDA 如何为某些需要批准前检查的申请设定审评时间表。
FDA 进行现场检查的能力受到新冠(COVID-19)疫情的严重影响。虽然 FDA 正在...
|

|
欧盟附条件批准辉瑞-BioNTech 新冠疫苗
2020.12.22
欧洲药品管理局(EMA)于 12 月 21 日周一建议欧盟委员会对辉瑞/BioNTech 的新冠(COVID-19)疫苗授予附条件上市许可,几个小时后欧盟委员会对疫苗签发了正式附条件上市许可(CMA)。欧盟范围内的首次疫苗接种预计将在本周末(12 月 27 日)开始。
EMA 对 COVID-19 疫苗...
|

|
印度新冠疫苗试验不良反应引发质疑,辉瑞疫苗需要在印...
2020.12.22
印度药品管理总局(DCGI)可能会要求辉瑞/BioNTech 寻求在印度的加速批准(类似于紧急使用授权)之前进行本地临床试验。
这可能是辉瑞/BioNTech 在全球批准道路上遇到的第一个关卡。在 12 月 9 日 DCGI 的专家委员会上,辉瑞印度公司曾希望有更多时间做介绍。在那之后,辉瑞...
|

|
新冠疫苗领跑者已撞线,后来者面临更多试验执行困难
2020.12.19
随着几款新冠(COVID-19)疫苗陆续在多个国家获得紧急使用授权或暂时使用,目前仍然在试验中的疫苗可能面临这更多问题,包括揭盲策略、参与者脱落、两种不同疫苗之间的相互作用等等。
在 FDA 上周批准首个 COVID-19 疫苗之时,阿斯利康向在美执行临床试验的研究者发出了文件,说...
|
|
FDA 关于 Moderna 新冠疫苗紧急使用授权的专家会资...
2020.12.18
美国 FDA 于 12 月 17 日召开疫苗与相关生物制品专家委员会(Advisory Committee)会议讨论 Moderna 的新冠(COVID-19)疫苗 mRNA-1273 的有效性和安全性是否足以支持紧急使用授权(EUA)。会议表决结果为:20 赞成,0 反对,1 弃权。有关会议讨论的详细报道请见【快讯】Mode...
|
|
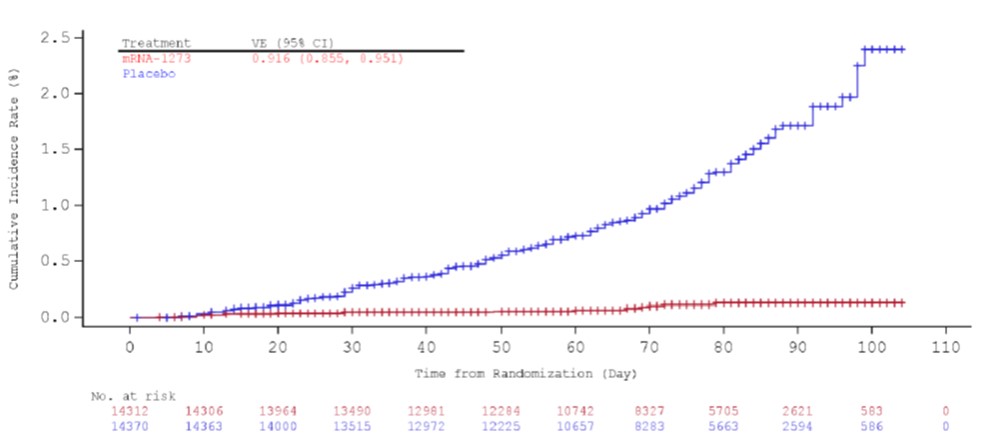
【快讯】Moderna 新冠疫苗专家会意见,20-0 支持紧...
2020.12.18
北京时间 12 月 18 日早 6 点 10 分,美国 FDA 就 Moderna 新冠(COVID-19)疫苗 mRNA-1273 的紧急使用授权(EUA)召开的专家会刚刚结束。在结束了一整天 8 个多小时对 Moderna 新冠疫苗的广泛讨论后,外部专家以 20 赞成,0 反对,1 弃权,认为基于可用全部科学证据,Moder...
|
|
欧盟新冠疫苗专家投票日期提前,使用附条件批准路径
2020.12.17
欧洲药品管理局(EMA)迫于政治压力预期将在下周就首个新冠(COVID-19)疫苗给出附条件上市批准建议。
EMA 之前计划“最迟”在 12 月 29 日之前就辉瑞/BioNTech 的 COVID-19 疫苗 BNT162b2 做出决定,但现在将这一决定提前至 12 月 21 日。EMA 专家的预期投票结果将...
|
|
Moderna 新冠疫苗专家会会前资料,非常有效但不良反...
2020.12.16
美国 FDA 于周二(12月15日)发布了针对 Moderna 新冠(COVID-19)疫苗紧急使用授权(EUA)的专家咨询委员会(advisory committee)的部分会前资料,FDA 审评科学家认为该疫苗安全有效。
在计划于本周四召开的疫苗和相关生物制品咨询委员会会议上,外部专家将投票表决 Moderna COVI...
|

|
FDA 现场检查替代计划进展缓慢导致关键新药审批停滞
2020.12.14
新冠疫情爆发已经近一年,由于旅行限制和边界关闭等因素,药品监管所必须的现场检查工作难以开展,许多疫情高发的国家和地区先后提出替代现场检查的办法,但是美国 FDA 到现在为止还没有实质性的改变,而这已经影响到一些患者急需的挽救生命药物的短缺问题。
前 FDA 合规和生物制品...
|

|
EMA 新冠疫苗数据被黑客攻击,冷链组织或也受到网络...
2020.12.11
欧洲药品管理局(EMA)于 12 月 9 日在其网站上发布了一条简短的通知,透露 EMA 遭到网络攻击,但没有关于攻击程度的任何细节。但德国疫苗开发商 BioNTech 发表声明表示,其与辉瑞公司合作开发的新冠(COVID-19)疫苗 BNT162b2 有关的提交到监管机构的文件存储在 EMA 服务器...
|
|
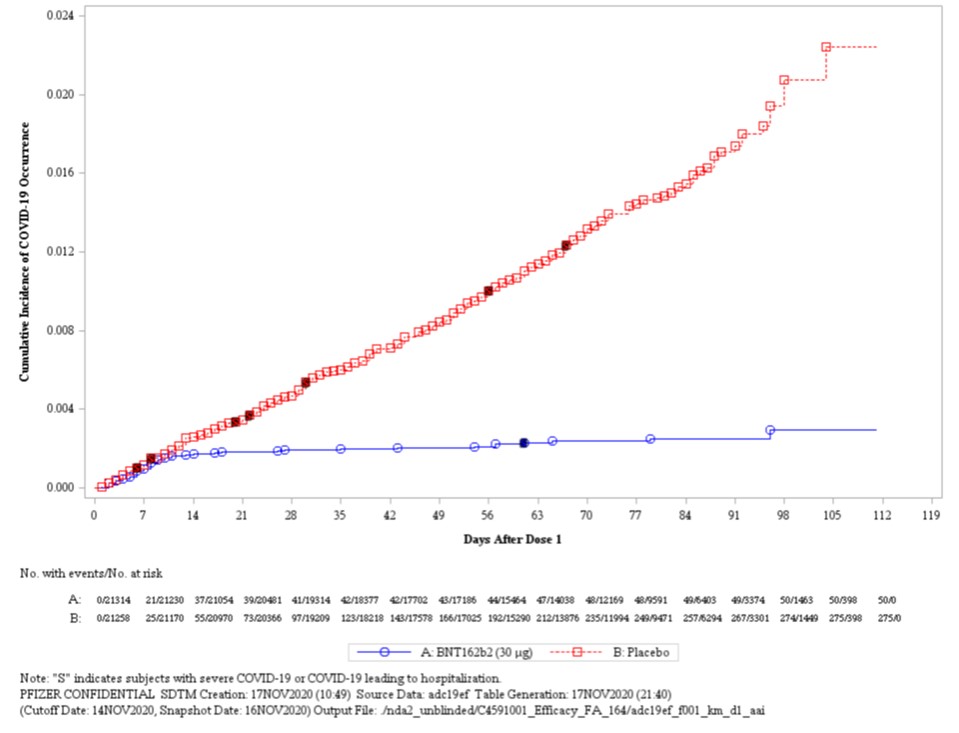
【快讯】辉瑞新冠疫苗专家会意见,17-4 赞成紧急使...
2020.12.11
截至发稿前 20 分钟(北京时间 12 月 11 日早上 6:40),美国 FDA 关于辉瑞-BioNTech 的新冠(COVID-19)mRNA 疫苗 BNT162b2 召开的专家会刚刚结束。
经过 8 个多小时的数据演示、问答、讨论和辩论,外部专家们就“基于现有的全部科学证据,辉瑞-BioNTech COVID-19...
|
|
FDA 疫苗专家会会前资料公布,认为辉瑞新冠疫苗非常...
2020.12.09
美国 FDA 在周二(12 月 8 日)发布的疫苗专家咨询委员会(advisory Committee)会前资料中认可了辉瑞和 BioNTech 的新冠(COVID-19)疫苗 BNT162b2 的有效性和安全性。
这些文件是即将在本周四举行的疫苗外部专家会议的背景材料,此次专家会颇受关注,被视为是 FDA 颁发首个 C...
|

|
柳叶刀发表阿斯利康新冠疫苗详细数据,具有中等保护效...
2020.12.09
牛津大学和阿斯利康正在开发的新冠(COVID-19)疫苗在预防有症状性疾病方面似乎具有中等效力,并且可能会大大减少疾病的住院率。
《柳叶刀》(The Lancet)于 12 月 8 日发表了牛津/阿斯利康 COVID-19 疫苗 ChAdOx1 的新数据1,该数据来自不同阶段的试验,并包含超过 20,0...
|

|
辉瑞和 Moderna 面临压力和批评,未承诺向发展中国...
2020.12.04
辉瑞/BioNTech 和 Moderna 有望在 2020 年底之前在美国和欧洲获得新冠(COVID-19)疫苗紧急使用授权,但发展中国家要获得其第一批疫苗可能要等上几个月的时间。
辉瑞/BioNTech 的 BNT162b2 刚刚在英国获得首个紧急使用授权,同时也有望在不久后获得美国和欧盟的授权。Moderna...
|
|
英国率先授权辉瑞新冠疫苗,欧盟和美国怎么看?
2020.12.03
北京时间 12 月 2 日晚的热门新闻之一恐怕是英国通过特殊立法程序临时批准使用辉瑞/BioNTech 的 BNT-162b2 疫苗了,这一批准标志该疫苗成为首个获准广泛分发的 mRNA 疫苗。
英国卫生和社会保障部表示,此次临时批准是在“几个月严格临床试验和由英国 MHRA 专家对数据进行...
|

|
阿斯利康新冠疫苗申请放弃高保护效力数据,英国开始滚...
2020.11.30
阿斯利康和牛津大学宣布将采用较低保护效力(62%)的一组数据,放弃使用争议颇大的高保护效力(90%)数据向监管机构递交申请,以期获得快速或附条件批准。英国 MHRA 已开始滚动审评,美国 FDA 可能不会接受这一数据。
上周阿斯利康和牛津大学公布了其候选新冠(COVID-19)疫苗 AZD...
|
|
FDA 解释瑞德西韦批准依据,暗驳 WHO 的否定建议
2020.11.27
美国 FDA 于 11 月 26 日不同寻常地发布了一篇关于介绍瑞德西韦批准用于 COVID-19 治疗的安全性和有效性证据的文章,但其主要目的似乎是为了回应公众对于最近 WHO 与 FDA 关于瑞德西韦用于治疗 COVID-19 的相矛盾建议的质疑。
FDA 在文中介绍了 FDA 对于瑞德西韦(品牌名:...
|

|
FDA 远程记录审查缺乏沟通互动引发业界担忧
2020.11.26
Alkermes 公司最近披露了其新型精神分裂症和双相情感障碍治疗药物 ALKS 3831 批准延期的原因,反映了自美国 FDA 3 月份由于大流行而暂停大多数现场检查并开始大量依赖远程记录审查以评估生产质量方面存在的问题。
另外还有一些企业表示,很难将 FDA 远程索要的记录与正确的背...
|